一、药品板块
1、征求意见
国家药监局综合司公开征求《药物非临床研究质量管理规范认证管理办法(征求意见稿)》意见
2022-10-21 国家局发布《药物非临床研究质量管理规范认证管理办法》,现公开征求意见。于2022年11月21日前反馈至电子邮箱:yjjyjc@126.com,邮件主题请注明“GLP认证管理办法意见反馈”。
该办法共包括6章内容:总则、申请与受理、资料审查与现场检查、审批发证和证书管理、监督管理、附则。具体内容见下图。
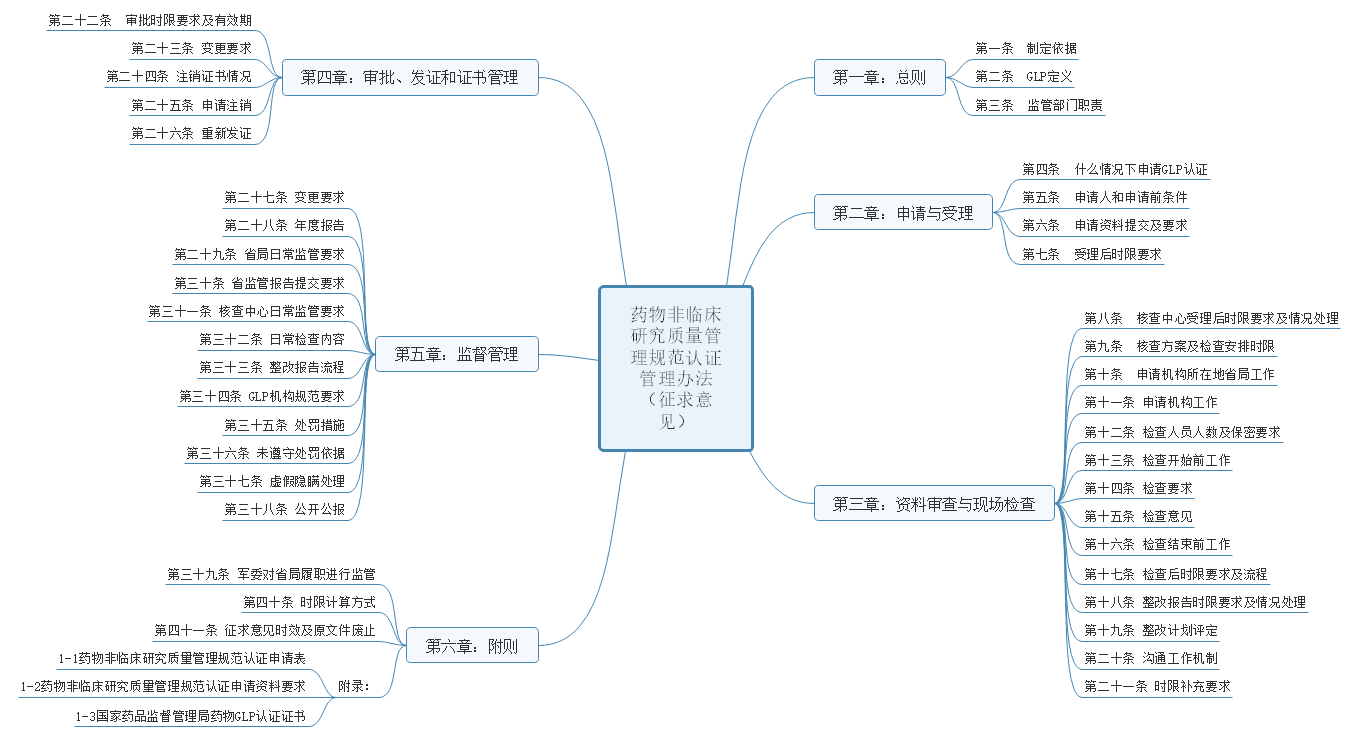
另外该办法同时也对申办资料做了具体要求,资料共分申请资料说明和要求两大部分内容,其中资料说明包括资质证明、机构概要、职责、人员情况、试验区域情况、仪器等校验情况、仪器设备一览表、文件目录、计算机运行情况、实施情况、以往检查情况、自检报告、其他资料,共计14项内容。详细内容见下图。
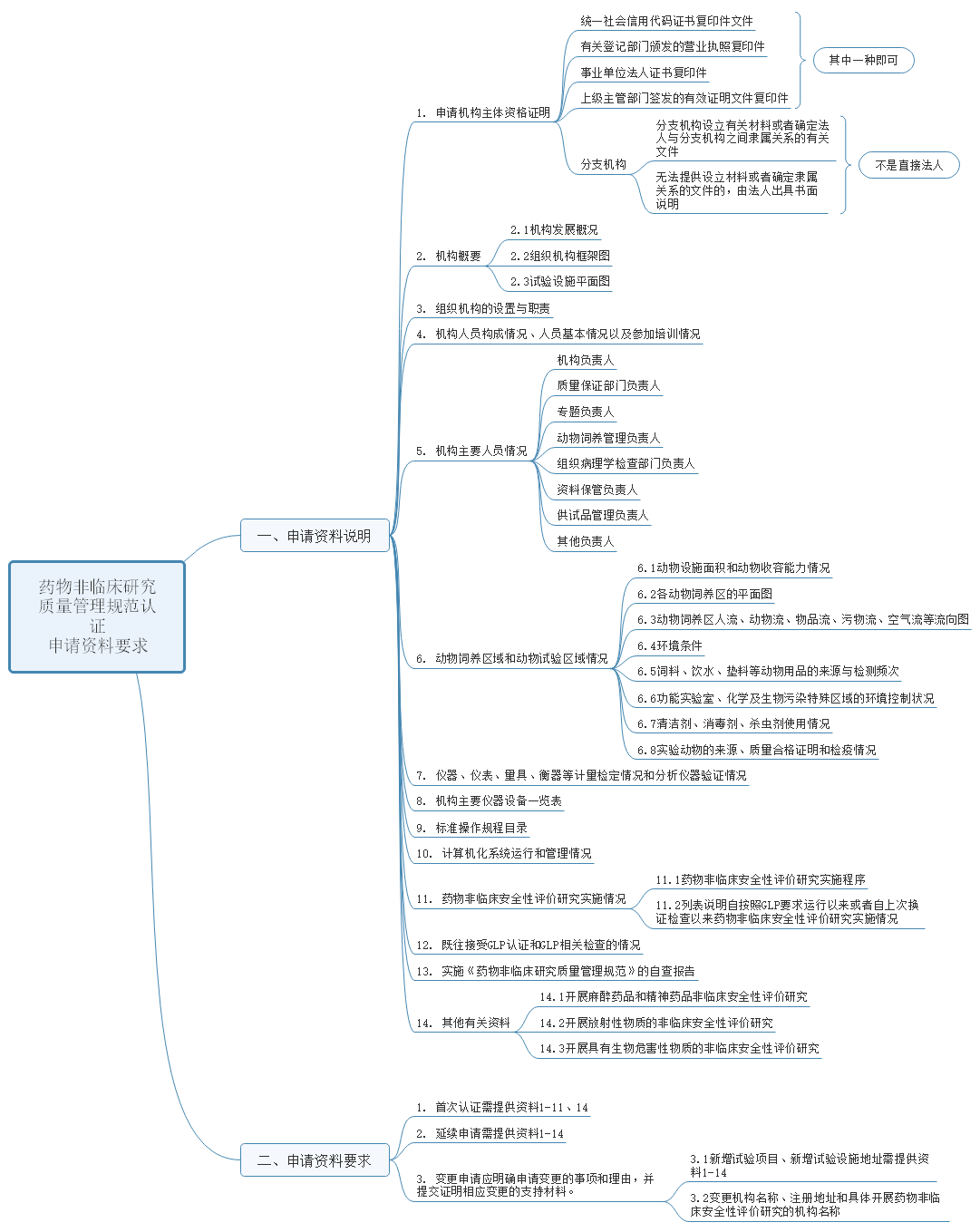
2、说明书修订
国家药监局关于修订己酮可可碱注射剂说明书的公告
2022-10-18 根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对己酮可可碱注射剂(包括己酮可可碱注射液、注射用己酮可可碱、己酮可可碱氯化钠注射液、己酮可可碱葡萄糖注射液)说明书内容进行统一修订。现将有关事项公告如下:
备案时限要求:上述药品的上市许可持有人均应依据《药品注册管理办法》等有关规定,按照己酮可可碱注射剂说明书修订要求,于2023年1月14日前报国家药品监督管理局药品审评中心或省级药品监督管理部门备案。
说明书标签具体要求:修订内容涉及药品标签的,应当一并进行修订,说明书及标签其他内容应当与原批准内容一致。
备案后说明书标签使用要求:在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换。
使用后研究:药品上市许可持有人应当对新增不良反应发生机制开展深入研究,采取有效措施做好药品使用和安全性问题的宣传培训,指导医师、药师合理用药。
使用要求:临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。
患者要求:患者用药前应当仔细阅读药品说明书,使用处方药的,应严格遵医嘱用药。
监管要求:省级药品监督管理部门应当督促行政区域内上述药品的药品上市许可持有人按要求做好相应说明书修订和标签、说明书更换工作,对违法违规行为依法严厉查处。
3、参比制剂
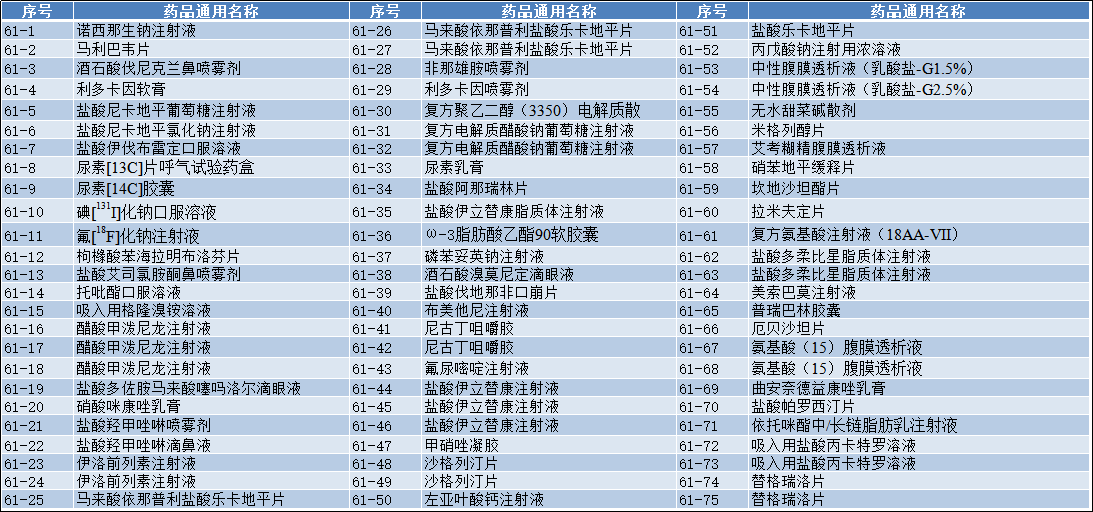
国家药监局关于发布仿制药参比制剂目录(第六十一批)的通告
2022-10-20 经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第六十一批)。
4、其他通知
4.1.2022年“全国安全用药月”将于11月中旬启动
2022-10-19 国家局发布公布2022年“全国安全用药月”重点活动方案及分工安排。根据方案,今年将举行第十一届“药品安全网络知识竞赛”、“中国药师周”系列科普活动、第五届“寻找身边最美药师”活动、“互联网+医药”服务及供应保障能力研讨会等十项主题活动。其中,2022年“全国安全用药月”启动仪式暨第七届中国药品安全论坛拟于11月在北京举行。各地要结合本地区实际策划开展“全国安全用药月”活动,使用统一的标识,形成全媒体全覆盖格局。要严格执行联防联控机制部署,加强新冠肺炎疫情防控,防止聚集性感染事件发生,确保各项活动顺利进行。
4.2.《中国食品药品检定研究院2021年度科技报告》发布
2022-10-21 在中检院科研管理处的组织下,经全院各部门和有关课题负责人共同努力,《中国食品药品检定研究院2021年度科技报告》编纂完成,现予以发布。报告比较全面总结和展示了中检院2021年度科技工作成效,供广大食品药品监督、检验人员和研究人员交流和参考。

二、器械板块
1、产品上市与注销
1.1.国家药监局关于注销医疗器械注册证书的公告
2022-10-19 按照《医疗器械监督管理条例》的规定,根据企业申请,现注销和悦医疗股份公司(Heyer Medical AG)呼吸机(Ventilator)的医疗器械注册证,注册证号:国械注进20203083010。
1.2.国家药监局关于批准注册222个医疗器械产品公告
2022-10-21 国家局发布,2022年9月共批准注册医疗器械产品222个。其中,境内第三类医疗器械产品163个,进口第三类医疗器械产品24个,进口第二类医疗器械产品33个,港澳台医疗器械产品2个。(具体内容点击公告链接)
国家药监局关于批准注册222个医疗器械产品公告
2、器械行业标准修改
2022-10-20 国家局发布YY 0719.2-2022《眼科光学 接触镜护理产品 第2部分:基本要求》等20项医疗器械行业标准及2项医疗器械行业标准修改单。(具体内容点击公告链接)
国家药监局关于发布YY 0719.2-2022《眼科光学 接触镜护理产品 第2部分:基本要求》等20项医疗器械行业标准及2项医疗器械行业标准修改单的公告
3、征求意见
3.1.关于征求《免疫组化类体外诊断试剂产品分类界定指导原则(征求意见稿)》意见的通知
2022-10-17 按照国家药品监督管理局要求,国家药品监督管理局医疗器械标准管理中心牵头,组织医疗器械分类技术委员会临床检验专业组研究编制《免疫组化类体外诊断试剂产品分类界定指导原则》(以下简称《指导原则》),形成征求意见稿及编制说明,现公开征求意见。2022年11月2日前发送至邮箱tws-xbs@nifdc.org.cn。
该指导原则对涉及免疫组化类体外诊断试剂产品分类的规则进行了梳理和细化。
适用范围:本原则中的免疫组化类体外诊断试剂产品主要是指用于检测冰冻切片、石蜡包埋组织切片及细胞制片等标本的抗体试剂及相关产品。免疫组化类体外诊断试剂产品的医疗器械分类界定可参考本原则。
管理属性界定:该类产品的管理属性界定应基于其预期用途进行判定。如该类产品用于临床检验,建议按照医疗器械管理。如果不用于临床检验(如仅用于科研实验室、教学等)建议不按照医疗器械管理。
管理类别界定:
预期用途为指导临床用药或伴随诊断免疫组化类体外诊断试剂产品,按照第三类医疗器械管理;
用于肿瘤诊断、判断预后的按照第三类医疗器械管理;
用于自身免疫病等的按照第二类医疗器械管理;
在H-E染色等显微镜观察/形态学诊断的基础上,一般为病理医师提供诊断/判断蛋白表达的阴阳性或蛋白表达的强度,辅助判断组织来源、分化程度、组织学类型或辅助显示蛋白类激素表达状态的辅助信息的免疫组化类体外诊断试剂产品,按照第一类医疗器械管理;
免疫组化检测用样本处理试剂(如内源性过氧化物酶阻断剂、显色剂、染色液)、反应体系通用试剂按照第一类医疗器械管理。
双抗体多抗体联合检测的试剂按照组合类产品管理,按照其明确预期用途进行判断,如果联合检测试剂的预期用途为用于肿瘤诊断、判断预后的,按照第三类医疗器械管理,用于自身免疫病等诊断的按照第二类医疗器械管理;
双抗体多抗体联合检测试剂没有明确的联合检测预期用途的产品,其管理类别按照联合检测中单独抗体试剂的最高类别管理,如单独抗体试剂的管理类别均为第一类医疗器械,则多抗体联合检测试剂按照第一类医疗器械管理。

