一、目的:
规范供应商管理,使物料来源处于可控状态,确保产品质量的稳定性和可靠性
二、原则:
质量管理部门应当对所有生产用物料的供应商进行质量评估,会同有关部门对主要物料供应商(尤其是生产商)的质量体系进行现场质量审计,并对质量评估不符合要求的供应商行使否决权。
主要物料的确定应当综合考虑企业所生产的药品质量风险、物料用量以及物料对药品质量的影响程度等因素。
企业法定代表人、企业负责人及其他部门的人员不得干扰或妨碍质量管理部门对物料供应商独立作出质量评估。
三、供应商选择原则
(1)必须是注册申报确定的供应商;如遇变更,应按规定办理变更批准。
(2)必须是资质齐全;
(3)必须是有产品生产许可批准证明文件、质量标准;
(4)经质量评估符合要求。
四、物料分级:
物料实行分级管理:综合考虑所生产的药品质量风险、物料用量以及物料对药品质量的影响程度等因素,将物料分为
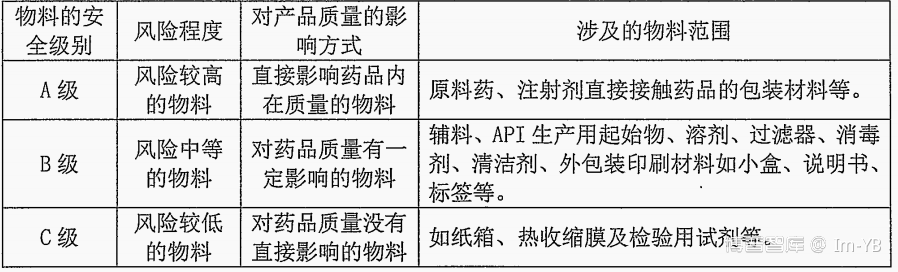
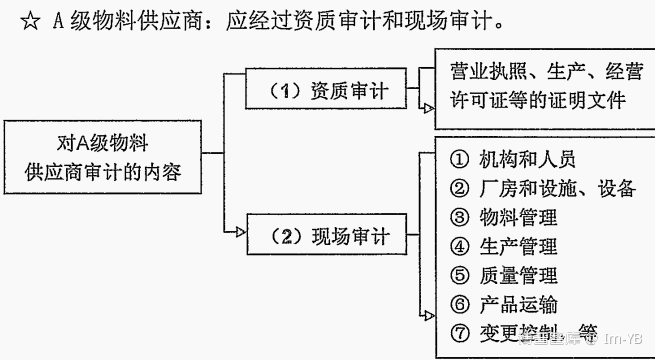
不同安全级别的物料供应商的审计内容:
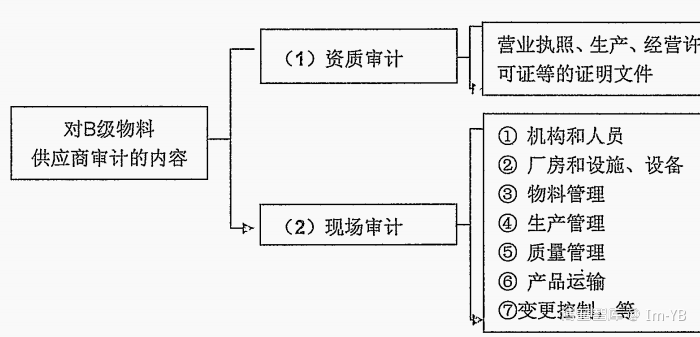
☆ B级物料供应商:进行资质审计即可。供应商批准后,如物料在使用过程,经风险评估存在较高风险的物料,应报请质量负责人批准决定是否进行现场审计。
☆ C级物料供应商:一般只考察其资质,只要其产品适用,均可以批准供货,除非对药品的外观、生产效率或其它方面有特别的不良影响,才需质量负责人对其实施否决。

☆研发用物料供应商或供应商为经销商时,进行资质审计,同时应按C级物料供应商规定的审计内容对物料的生产企业进行审计。
五、供应商评估方式:包括“资质审计”和“现场质量审计”。
(1)资质审计:材料,并对这些资料进行审核确认。
(2)样品检验:
(3)小批量试制:
(4)现场审计:供的资质真实性、检验报告的真实性、核实是否具备检验条件。还应当对其人员机构、厂房设施和设备、物料管理、生产工艺流程和生产管理、实验室的设备、仪器、文件管理等进行检查,以全面评估其质量保证系统。
(5)由质量受权人从各相关部门选定人员成立供应商现场审计小组,小组成员应具有不少于三年的药品生产质量管理的工作经验,一般由质量管理部长、主任、生产负责人、釆购经理等相关人员组成。
(6)现场审计内容:理体系以及对产品的质量和安全方面进行风险评估,同时给岀合格、不合格供应商的结论,并书面反馈给供应商。
六、供应商评估标准资质审计评估标准
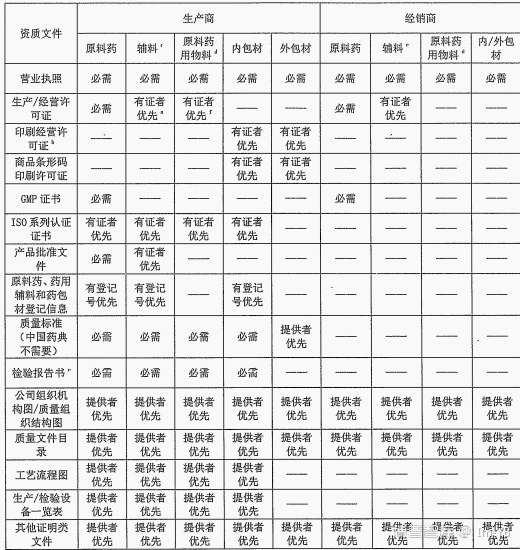
注:a.
b.
c.
d.API物料,属危险化学品或易制毒化学品的,还应有危化品
e.
f.API属
七、样品检验:应符合公司制定的质量标准。
(1)小批量试制的产品:品在规定的贮存条件下质量稳定。
(2)现场审计评估标准:备、物料管理、生产工艺流程和生产管理、
(8)供应商审计的实施

(9)由釆购员向供应商索取资料和样品。
(1)供应商首次审计在尽可能的情况下索取以下供应商资料营业执照;相关生产
(2)首次审计的A级物料供应商,质量管理部还应将“供应商调查问卷”邮寄或传真 给供应商,请供应商填写后寄回,并与上述文件资料一起交
(3)向供应商索取的样品量一般为全检量(由QC确定)的3倍,贵重物料可以适当减量。如果是变更
(4)QA收到供应商提供的相关资料和样品后,应立即审查资料的完整性。资料完整的,收下进一步审核;反之,退回釆购部补充。
(5)QA应按规定的物料级别和不同级别物料供应商的审计内容,对供应商进行初步评估,确定对供应商进行资质或现场审计。若属
八、样品的请检、检验
(1)供应商提供的样品,如为原料药、辅料、原料药生产用物料时,QA填写请检单,在请检目的项注明应商审计”,然后将样品与请检单、质量标准(有中国药典标准的 不需要)
(2)QC收到供应商审计样品请验单和样品后,按质量标准和相关规程及时检验样品,并岀具检验报告交
九、小试工艺研究与试机
(1)需进行小试工艺试验的物料,对试生产的药品检验合格后,QA应将剩余样品送交研发或质量管理部进行相关试验。供应商提供的样品不足的,QA应及时通知物料储运部,要求供应商增加提供样品。
(2)需进行上机测试与设备匹配性的胶囊、冷冲压成型固体药用复合硬片、铝箔、PVC、复合膜等,供应商应将样品交车间安排试机,试机后车间应编写试机确认记录
十、供应商的评估确定:
(1)由主管供应商审计的QA填写《供应商评估审批表》,经生产负责人、物料主管等人员审核后,质量负责人根据供应商的资质证明文件、质量标准、检验报告、公司对物料样品的检验数据和报告、或现场质量审让报告以及小试产品的检验报告和稳
(2)定性考察报告等进行审核,决定该供应商是否是合格供应商,并及时更新合格供应商目录。
(3)A、B级物料供应商审计合格后,需签订质量协议。
十一、定期审计
(1)☆定期资质审计:购的物料是否仍在该供应商的生产、经营范围内,变更后是否更新资料等。
(2)☆定期现场审计:年进行现场全面审计,同吋跟踪上次审计发现的问题以及年度质量回顾中存在的缺陷,落实整改是否到位,对本次审计发现的问题提出整改意见。如发现严重缺陷,存在高的质量风险,则报请质量负责人批准撤销合格供应商资格,对已使用该物料的产品进行风险分析并釆取相应的措施。
十二、原因审计
(1)QA根据物料验收和日常使用过程发现的质量问题,及时反馈给供应商并要求整改。
(2)供应商的产品出现严重的质量缺陷;供应商供应的产品造成本公司产品发生质量事故时;供应商的生产设备,生产工艺发生重大变化时;供应商供货的生产场所发生变化等非正常情况发生时,应对供应商和物料进行风险评估,对存在高风险的,应立即报请质量负责人,由质量负责人决定是否进行现场审计或撤销其合格供应商资格。
十三、供应商回顾评价
(1)每年第一季度,QA应对上一回顾周期内每个物料的供应商进行回顾性评价,并根据评价结果,确定供应商是否继续选用,
十四、供应商变更管理
选定供应商后,应尽可能避免不必要的变更,以确保产品质量的稳定性和可靠性。有以下情况之一,
QA可以提出撤销供应商资格,经质量负责人批准后,通知物料储运部,并更新合格供应商目录:
(1)供应商产品质量不稳定严重影响本公司产品的质量或供货产品连续三批检验不合格;
(2)供应商的定期或日常审计不合格且缺陷不能及时更改;
(3)供应商的供货(数量、规格等)不能满足生产需要;供应商内部发生重大变化等
(4)供应商停产或经营出现危机;
(5)存在其它危及公司正常生产和产品质量的情况。
(6)现有物料需要增加新供应商或改变供应商时,由物料储运部提出申请,按《变更控制管理规程》上市化学药品变更研究的技术指导原则”的要求执行。
(7)现有原料、辅料、内包材料及有气密性要求的外包装材料需要增加新供应商或变更供应商时,质量管理部应会同物料储运部、生产技术部、研发部等相关部门进行沟通,评估决定实验的项目和对产品进行相关的验证及稳定性考察。
十五、供应商档案管理QA负责建立和维护所有原辅料、包装材料的供应商档案,以提供产品质量改进和审计所需的信息。
十六、供应商档案内容应包括:
(1)供应商的资质证明文件
(2)质量协议
(3)质量标准
(4)样品检验数据和报告
(5)供应商的检验报告
(6)现场质量审计报告
(7)产品稳定性考察报告
(8)定期的质量回顾分析报告等。
十七、MAH产品的物料变更管理规定
物料变更:物料变更可由MAHMAH(委托方)负责物料供应商及供应商审计管理,提供物料供应 商名单给受托生产企业。物料变更申请和执行报告由受托生产企业质量管理负责人、MAH(委托方)质量负责人/质量管理负责人共同批准。
以上内容仅供参考,还请各位同行多多指教批评!

