一致性评价注册申报流程
首先“一致性”是指仿制药与原研药(或“参比制剂”)的治疗等效(therapeutically equivalent)“治疗等效”又包含了两层含义。
一是药学等效(pharmaceutically equivalent),是指同样的剂型要包含同样量的原料药,并符合同样的或法定的质量标准;
一是生物等效(bioequivalent),是指具有同样的临床有效和安全性。
仿制药申请又称为简化新药申请,通过简单的PE/BE试验,从而免去大规模临床试验,最终实现可替换性。在开展一致性评价过程中,药品生产企业须以参比制剂为对照,全面深入地开展比对研究:包括处方、质量标准,晶型、粒度和杂质等主要药学指标比较研究,以及固体制剂溶出曲线的比较研宾以提高体内生物等效性试验的成功率,并为将药品特征溶出曲线列入相应的质量标准提供依据。
具体流程如下:
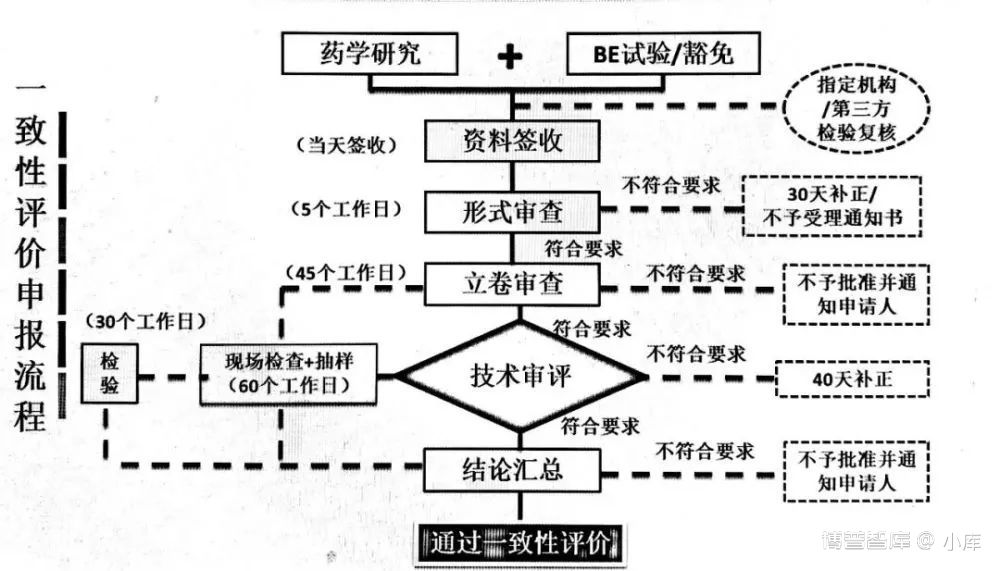
一致性评价生产现场检查程序
申报前:
需要提交一下资料:
《生产现场检查申请表》;《现场主文件》;《生产现场检查准备情况》
审评中
做好核查准备:
1、首次会PPT
2、现场需要准备的文件
检查中
全力配合检查:
1、收到检查通知后及时排产
2、保证检查中相关人员到位
3、做好核查老师接待工作
检查后
检查后送检:按通知书要求送检;跟踪检验机构结果,及时沟通。
药品一致性评价生产现场相关准备资料众多,需要反复核对确保与实际情况相符,提前将资料准备充分。
现场检查的特点
研制现场核查:药学研制现场核查;临床试验核查(BE试验);非临床研制现场核查(如有)
生产现场检查:报产3批动态现场检查
检查的核查主体
省局不再实施现场检查核查,而是作为国家局的检查力量参与。通常2-3人,构成通常为:一位GMP专家、一位分析专家及其他。
检查关注点
真实性(资料真实性);一致性(车间一致、批量一致、处方工艺、原辅料、设备一致);数据可靠性(数据可追溯);合规性(符合GMP要求)
一致性评价生产现场检查相关资料准备
《一致性评价生产现场检查申请表》:增加了批准文号、上市生产批量、现场检查批量、生产线取得药品GMP证书情况、认证范围、认证时间/上次接受现场检查时间、BE研究批情况、工艺验证批情况、近3年生产情况等。
《现场主文件》:现场主文件(Site Master File)内容包括企业总体情况,生产质量管理体系,人员,厂房和设备,文件,生产,质量控制,分销、投诉、产品缺陷与召回,自检等9个方面,是一致性评价资料中最为核心的资料之一,需要引起重视。
《生产现场检查准备情况》:这部分资料主要针对的是该品种的情况,包括了人员、原辅料包材、生产线、共线品种、工艺验证、清洁验证、设备确认、中间产品质量控制、检验、稳定性考察、BE批产品生产情况、动态考核批计划安排、GMP执行情况及上次GMP检查缺陷整改等。
检查前的相关准备
1.接受现场检查品种仿制药质量和疗效一致性评价全套注册申报资料。
2.委托生产协议和质量协议,(根据实际情况而定)。
3.参比制剂的来源及证明,如购买发票、赠送证明等。参比制剂的包装标签、说明书、剩余样品等。参比制剂的接收、发放、使用记录或凭证。
4.药品生产相关规程,包括:生产工艺规程;标准操作规程(产品相关生产操作规程、设备操作规程、原辅料取样检验操作规程);原批准的质量标准和申报的质量标准;空白批生产记录(批生产主记录)。
5.一致性评价工作所涉及的所有生产批次(含BE批、工艺验证批等)相关记录,包括:批生产记录;批检验记录;稳定性试验记录;仪器设备使用记录;纸质图谱及电子图谱。
6.工艺验证方案和报告,以及设备确认、批量、清洁验证情况。
7.药品所有生产批次(含BE批、工艺验证批)的供应商档案。
8.药品所有生产批次(含BE批、工艺验证批)的物料台账及相关单据。
9.BE批的体外评价资料。
10.溶出度仪的验证资料。
11.药品所有生产批次的剩余样品情况(不应销毁)。
12.近三年产品年度质量回顾报告。
13.近3年该品种生产线接受境内外检查机构检查情况及整改资料。
一致性评价生产现场检查的主要内容
1、机构和人员
企业应建立药品生产和质量管理组织机构,并能够确保各级部门和人员正确履行职责。
相关重点
(1)组织机构图是否涵盖了生产、质量、仓储、设备等方面的内容
(2)研发、生产人员的数量级资质
(3)质量管理部门的职责、生产管理部门的职责
(4)变更、偏差、CAPA管理制度
参与样品批量生产的各级人员,包括物料、样品生产、质量检验、质量保证等人员是否具备履行其职责的实际能力
相关重点
(1)各级人员是否能对新增品种的物料管理,样品生产及质量检验熟练掌握;对发现的问题能否判断并及时处理。
(2)是否有书面的形式规定了所有从事生产人员的责任。
样品批量生产前上述人员是否进行过与本产品和质量控制有关的培训及药物GMP培训,并有培训记录。
相关要点:
培训记录的完整性,是否有关于申报品种相关的培训内容
2、厂房与设备
生产厂房及其设施、生产设备、仓储条件等应满足样品批量生产的要求。
(1)现场检查是否有本产品的生产条件;
(2)仓储是否符合本品的储存条件
生产批量应与实际生产条件和能力匹配
(1)动态生产的批量应与现场生产设备相适应
(2)现场生产设备的型号、容量等关键指标要与申报资料中一致,不得使用未经申报的设备生产样品
(3)批量的大小与现场设施、设备相适应
非专有生产线的,应充分评估新增产品与原有产品安全生产方面的风险,并能有效防止交叉污染
对新增品种所使用的设备进行清洁验证,清洁方法验证。风险评估人员差错、生产管理疏忽、厂房的清洁消毒、物料管理、过滤器是否混用等多环节评估分析。
一致性评价,原有厂房、设施等做了变更的、应按照要求经过必要的确认或验证
3、原辅料与包材
是否制定原辅料和包装材料的购入、储存、发放、使用等管理制定并严格执行。
相关重点
(1)现场检查时查看上述规章制度,并对其实际执行情况进行检查
(2)物料应建立台账和货位卡,物料存放位置和数量等应与货位卡标明的一致
(3)应按照各种物料的储存要求存放,并防止交叉污染
对起始物料、辅料、直接接触药品的包装材料进行供应商进行审计,并建立供应商档案
(1)是否经质量管理部门批准
(2)是否建立了关键物料供应商评价制度,必须证明供应商能够稳定提供符合质量标准的物料
(3)若供应商不是生产厂,是否有原始生产厂家的资料
批量生产过程中使用的物料必须有合法来源,与注册申报资料中载明的是否一致
(1)物料的发票、购货合同、药品注册证、进口药品注册证、检验报告等材料
(2)仓库库存、车间使用的物料是否与申报资料中一致
应制定原辅料、包装材料的内控标准、取样规程
相关重点
(1)对使用的原辅料、包装材料进行检验,应有检验规程、sop、原始记录和检验报告书等文件
(2)对样品的抽样、检验等过程进行检查,如抽查某物料的进货量、件数、取样时间、取样量、取样容器;取样后被取样的物料包装的密封、标记情况,样品的登记、储存和分发的情况
(3)库房设置取样间,洁净级别,是否有监测和验证数据
4、样品批量生产过程
工艺规程的内容与核定的处方、工艺以及批生产记录的内容一致
要有详细的工艺步骤(如物料的核对、预处理、加入物料的顺序、混合时间、温度等),要注意中间体的控制与限度。
工艺验证数据应支持批量生产的关键工艺参数
检查三批产品验证的完整记录,看工艺运行是否稳定,特别要看这三批产品生产过程中出现的偏差及处理意见。
检查三批验证产品的批档案,看是否符合GMP可追溯性的要求,是否存在某物料无标准生产的偏差
应进行清洁验证
有无清洁验证规程,规程中是否规定清洁方法(使用什么水或清洁剂、温度、压力、时间、经清洁后设备可贮存的最长时间。
同品种不同批之间的清洁、品种变更时的清洁是否有明确规定和记录
生产现场操作人员应按照工艺规程、岗位SOP的要求进行操作
现场查看操作人员是否按照文件规定进行各项操作,操作的熟练程度。
对生产过程中出现的问题能不能及时处理,操作过程中是否有违反GMP相关规定的情况。
批生产记录应真实、完整、及时。
生产以及重要中间工序开始、结束的日期和时间;每一生产工序的操作人、复核人的签名;
已生产批次样品的使用量、库存量与实际生产量是否一致;样品生产使用的物料量、库存量与总量是否吻合
5、QC实验室
否具有样品及相关原辅料检验所需的各种仪器、设备、标准物质等。要点:从申报资料中抽取有代表性的图谱进行溯源检查;标准品、对照品等的来源、使用及库存情况,是否与申报资料一致。
检验仪器、设备是否经过校验,仪器是否有使用记录。
要点:查看仪器校验记录、证书等证明性文件;查看仪器使用记录。
是否有委托检验,如有委托是否符合相关规定,要点:不能做到全检的应有委托检验合同(协议)
质量控制部门是否具有与样品检验相关的文件
要点:与申报资料一致的质量标准;取样规程和记录;申报品种的检验操作规程和记录;申报品种的检验方法验证记录,包括微生物限度检查方法验证资料。
是否按规定留样并进行稳定性考察
要点:稳定性考察留样应足够,建议长期保存;稳定性试验方案应与申报资料一致:包括影响因素、加速试验、长期稳定性试验条件、考察指标、样品包装材料等;及时对稳定性考察作记录。
一致性评价生产现场检查的要点
1、一致性
关注申报资料与药学研究、体外评价、生物等效性研究和临床研究及实际生产过程中原辅料及内包装材料的来源、成品处方与生产工艺、生产批量的一致性。
2、物料系统
主要围绕物料的采购、接收、贮存、检验、放行、发放、使用、退库、销毁全过程进行的检查。
3、生产系统
检查主要围绕生产过程中生产工艺处方与申报资料一致性、近期的批生产记录及相关的物料发放记录、防止污染与交叉污染措施的有效性等。
关注生产环境、设备、设施是否符合品种生产的要求,关键生产设备生产能力是否与品种批量生产相匹配及相关的工艺验证情况。
4、质量控制与质量保证系统
除对实验室常规检查外,应重点关注产品年度质量回顾(包括OOS、偏差、变更)、分析方法的建立与验证、药物溶出度仪确认、稳定性考察情况、关键质量属性研究数据。
5、数据可靠性
关注申报资料中数据的真实性与可靠性,申报数据与原始数据的一致性,确保准确真实、清晰可追溯、原始一致、及时同步记录、能归属到人、完整持久。
参比制剂和对照品
原始证明性材料是否符合要求,台账是否完整;是否考察了与一致性评价紧密相关的关键质量属性,如性状、晶型(原料)、水分、溶出度、含量、有关物质等。
药典对照品、其他来源的外购对照品或自制对照品的来源及原始证明性材料是否符合要求。如为工作对照品,是否有完整的标化记录。
数据可靠性
1.计算机系统的用户分级管理与权限设置是否合理。
2.计算机化分析仪器是否开启审计追踪功能。
3.原始电子数据是否与申报的纸质数据一致。
4.质量研究及稳定性试验原始试验图谱是否真实可信;是否有篡改图谱信息、一图多用的现象;是否存在修改进样时间,删除不合格数据等问题;
IR、UV、HPLC、GC等具数字信号处理系统打印的图谱是否具有可追溯的关键信息(如带有保存路径的图谱原始数据挖掘名和数据采集时间),各图谱的电子版是否保存完好,是否有备份及备份记录。
5.是否制定了相关规定对数据的产生、采集、记录、处理、审核、报告、存储、存档、销毁等过程进行管理。
以上为一致性评价现场检查中应注意问题的汇总,希望对你有所帮助。
文章转自:药研
内容来源:行舟Drug

