近年来,由于快速发展的新技术以及监管的期望提高(如中国GMP2010版及附录计算机化系统),被监管公司采取积极行动以保持其已有GxP相关系统处于验证状态是至关重要的。
遗留系统的概念
未经验证或没有充足的证据证明其能满足现有法规要求的一个受GxP监管的运行系统。其特点主要如下:
已在生产中使用的
不认为是满足监管期望的
未经验证的
验证的益处
保证系统满足需求,包括业务流程需求以及GxP需求
理解符合法规(如EU GMP附录11)所需采取的行动
增强对旧系统的信心
证明用户能保证系统在一个合适的水平上运行
提供一个变更控制管理的基准线
潜在的减少系统维护费用
其他
相关法规要求
PIC/S检察官指南PI 011-3:应对没有充足文件证明符合验证目标的现有计算机化系统的继续使用给出合理的解释。
导致系统遗留的可能原因
忘记将其纳入验证计划
未遵循相应的验证规程
最初经过验证,但之后忽略了再验证等工作
关于以下情况的变更
范围与使用(使用中变更)
法规(法规变更或升版)
产品类型(更换产品)
公司相关业务(转向它国市场)
验证实施的一般原则
无需重建所有项目文件,只需保证设定目标可以达到即可
注重关键问题
深入理解工艺流程以及系统对于产品质量和用户安全的影响
验证的基本流程方法
引入生命周期的概念
规范和验证的方法
质量风险管理
下图清晰展示了遗留计算机化系统验证的流程和方法。
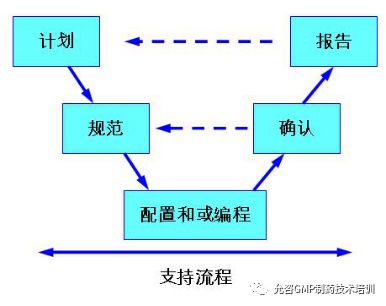
图1遗留计算机化系统验证V-模型流程
文章来源:允咨GMP制药技术

