持续工艺确认
第三阶段验证的目标是在商品化生产期间持续保证工艺处于受控状态(已验证状态)。持续工艺确认计划提供一种手段,来确保工艺确认阶段成功后工艺仍处于受控状态。持续工艺确认计划必须建立一个持续和不断发展的监测程序,收集和分析与产品质量有关的信息和数据,从而使探测出非期望的工艺变异。通过评估工艺性能,发现问题和确定是否采取行动整改、提前预见和防止问题,从而使工艺保持受控。除此之外,为了维持验证状态,持续工艺确认计划还需建立基于事件的审核系统,就审核结果与生产、质量、药政利益相关者进行沟通,修改控制策略(改进或出于法规符合性等原因)。
1、
某产品特定的持续工艺确认计划应包括至少以下要素:
各职能小组的角色和职责
取样与测试策略
数据分析方法的选择与应用
可接受标准
超趋势(OOT)和超标准(OOS)结果处理策略
质量体系内定期审核的要求(如,偏差、变更,物料及产品质量,投诉,设备设施维护状况等)
确定哪些工艺变更/趋势要求追溯至第一阶段和/或第二阶段的机制
重新评估持续工艺确认测试计划的时间
2、
持续工艺确认监测计划一般开始于第一阶段的控制策略制定时期。理想状态下,持续工艺确认监测计划大部分的控制策略是在第二阶段之前,实施工艺性能确认时建立的。
图1列举了整个生命周期内开发持续工艺确认监测计划的策略。
图1 持续工艺确认监测计划的开发
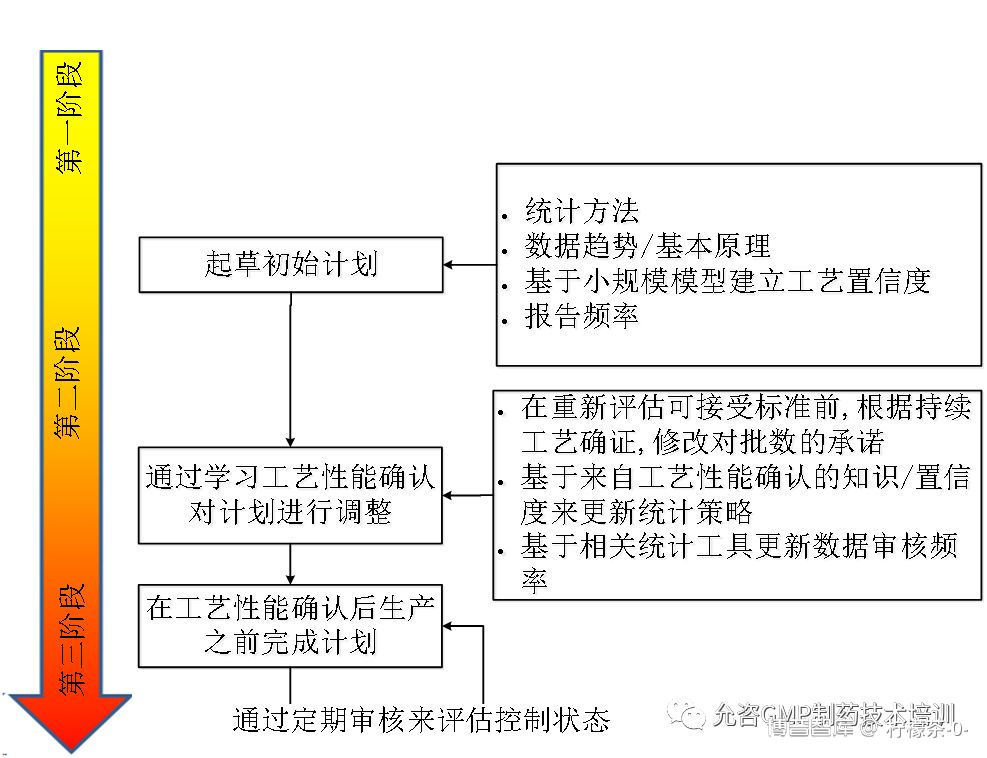
当将持续工艺确认概念用于既有产品时,应以评估的方法来决策。若老工艺有良好的检测和控制,则无需过多行动。但决策前应进行大量历史工艺、监控数据的评价,并对工艺变异性进行评估,以此为基础进行决策。如图2所示:
图2 老产品持续工艺确认监测计划判断
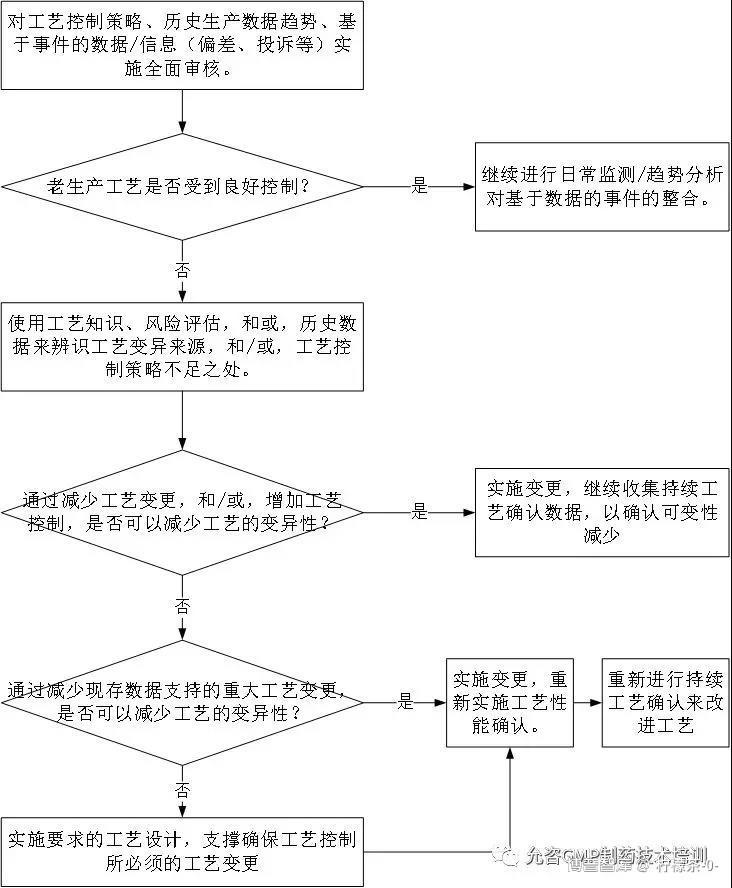
3、
进入商业生产阶段后,除了建立持续监测程序,对工艺趋势进行分析描述外,还应需要一个基于事件的审核系统,通过及时分析、评价缺陷投诉、对偏差/变更的调查、工艺偏离报告、生产率差异、批报告,引入的原材料报告及不良事件报告、厂房设施/系统设备的日常监测/维护/校准等,可以探测到变异。通过与相关部门评估数据、讨论意料之外的工艺变异,并通过生产协调任何整改和后续行动。这是一个反复的过程,反馈机制可以选择立即(批内或实时)反馈,每批次后反馈、一系列批次后反馈或规定时间反馈。反馈机制应在计划中明确。
4、
持续工艺确认计划需要包括一个数据采集机制及质量体系信息的审核频率。不同的工艺水平的审核间期差异可能很大,其取决于相关的风险水平以及控制的复杂性。随着更多生产数据的生成,对工艺理解的加深,对控制的证明可能会更加容易,相应的会导致审核间期缩短或审核强度降低。持续工艺确认数据审核总结报告可为年度产品质量回顾提供充足的数据支持。频繁的持续工艺数据审核可有助于增加生产商行为的主动性,减少被动性。年度产品质量回顾可辨识任何持续工艺确认数据审核中的差距,并总结长期趋势,但更频繁的持续工艺确认数据审核应由生产商在规定的期间内实施。
按照ICH-Q10要求,审核必须包括高级管理层,他们是维持药品质量体系有效性及提倡持续改进的重要利益相关人。
持续工艺确认报告/文件应包括(不限于):
CPP,CQA的评估与确定
数据分析与趋势
物料与产品质量分析
OOS、OOT、偏差、变更分析报告
厂房/设备设施日常监测、校准、维护情况分析
持续工艺确认报告汇总与整体
文章来源:允咨GMP制药技术

