1. 概述
无菌工艺(Aseptic processing):无菌药品按生产工艺可分为两类,采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
无菌药品的生产工艺一般分为最终灭菌工艺和无菌生产工艺,二者之间存在本质区别。
最终灭菌工艺通常要求在严格的生产环境中进行产品灌装和容器的密封。在这种环境下进行灌装和密封能够尽可能降低中间产品的微生物和微粒污染,结合后续的灭菌工艺,将更好的确保产品的无菌保证水平。在大多数情况下,在最终灭菌前,药品、容器和密封组件可以将灭菌前药品的微生物污染水平控制在较低的范围内,但不能达到无菌状态,所以产品在最终容器中密封后需要接受灭菌处理,比如热力学灭菌或辐射灭菌。
在无菌生产工艺中,药品、容器和密封组件首先以适当的方式分别灭菌或除菌,然后组合到一起。 因为产品在最终容器中密封后不再进行灭菌处理,所以必须在更为严格的生产环境中进行产品灌装和容器的密封。相对于最终灭菌工艺,无菌操作工艺存在更多的可变因素。 在组合成最终的无菌药品之前,产品的每个部分通常都要接受不同的灭菌处理。比如,玻璃容器进行干热灭菌;胶塞进行湿热灭菌;药液进行过滤除菌等。以上生产工艺均要求验证,并需要进行过程控制。任何一个工序如发生失误,都可能导致产品受到污染。
在无菌操作过程中,对于已灭菌的药品、各种部件、容器或密封组件的手工操作或机械操作均会产生污染的风险,必须进行严格控制。而最终灭菌药品在密封容器中经过最终灭菌,可以有效降低因操作失误造成的质量风险。因此在条件允许的情况下,应尽可能采取最终灭菌的方式生产无菌药品。当最终灭菌对产品质量造成损害时,可以采取经过验证的替代方法生产无菌药品。 例如,有些情况下,可采用在无菌生产工艺的基础上增加热处理的方法,以更好地保证产品的安全性。
2. 法规指南
2.1 国内药监
第四条 无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
第十三条 无菌药品的生产操作环境可参照表格中的示例进行选择。
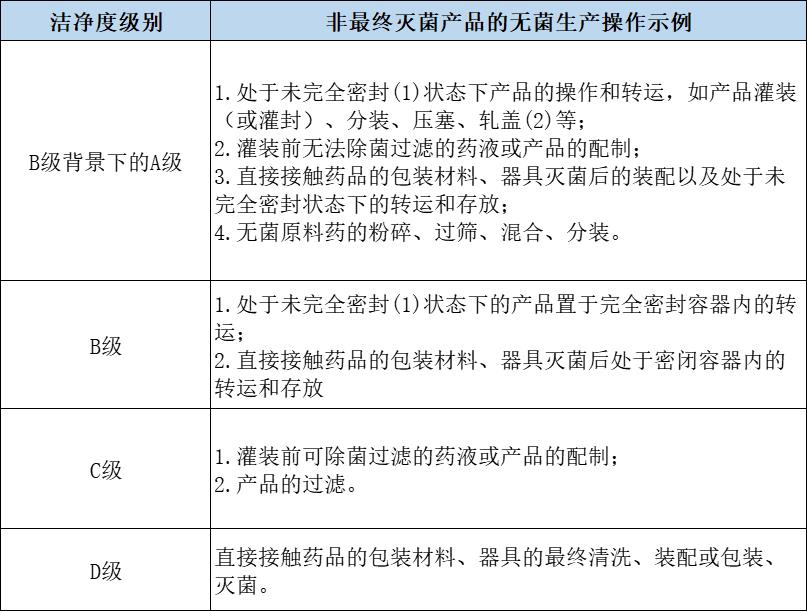
注:
(1)轧盖前产品视为处于未完全密封状态。
(2)根据已压塞产品的密封性、轧盖设备的设计、铝盖的特性等因素,轧盖操作可选择在C级或D级背景下的A级送风环境中进行。A级送风环境应当至少符合A级区的静态要求。
第七十五条 非最终灭菌产品的过滤除菌应当符合以下要求:
(一)可最终灭菌的产品不得以过滤除菌工艺替代最终灭菌工艺。 如果药品不能在其最终包装容器中灭菌,可用0.22μm(更小或相同过滤效力)的除菌过滤器将药液滤入预先灭菌的容器内。由于除菌过滤器不能将病毒或支原体全部滤除,可采用热处理方法来弥补除菌过滤的不足。
(二)应当采取措施降低过滤除菌的风险。 宜安装第二只已灭菌的除菌过滤器再次过滤药液,最终的除菌过滤滤器应当尽可能接近灌装点。
(三)除菌过滤器使用后,必须采用适当的方法立即对其完整性进行检查并记录。 常用的方法有起泡点试验、扩散流试验或压力保持试验。
(四)过滤除菌工艺应当经过验证,验证中应当确定过滤一定量药液所需时间及过滤器二侧的压力。 任何明显偏离正常时间或压力的情况应当有记录并进行调查,调查结果应当归入批记录。
(五)同一规格和型号的除菌过滤器使用时限应当经过验证,一般不得超过一个工作日。
2.2 FDA
Sec. 211.42 设计与建造特点
(c) 操作应在明确规定且大小适宜的区域内进行。在以下程序的过程中,对于有必要防止污染或混淆的操作,应具备独立或指定的区域或其它类似的控制系统:
(10) 无菌工艺,视情况包括:
(I) 地板、墙壁和天花板应光滑,表面坚硬易清洁;
(ii) 温度与湿度控制;
(iii) 在正压下,经高效空气过滤器过滤送风,层流或非层流均可;
(iv) 环境监测系统;
(v) 房间和设备的清洁,消毒系统,以产生无菌环境;
(vi) 控制无菌环境的设备维护系统。
Sec. 211.113 微生物污染的控制
(b) 应制订并遵循有关防止无菌药品微生物污染的适当的书面操作规程。此类操作规程应包括所有无菌和灭菌工艺的验证。
Sec. 211.167 特殊检验要求
(a) 对每批无菌和/或无热原的药品,应进行适当的实验室检验以确定其与要求的符合性。应制订并遵循检验的书面操作规程。
2.3 EU
无菌配置和工艺
8.7 无菌配置和工艺是在受控环境下对无菌产品、容器和/或器械的处理,受控环境是指送风、物料和人员受到管控以防止微生物、热原和微粒污染。
8.8 无菌工艺应清晰界定。应识别、评估并适当控制无菌工艺相关风险以及任何相关要求。工厂的CCS应明确界定这些控制的可接受标准、监测要求及其有效性的审核。应描述控制这些风险的方法和程序并执行。应正式记录可接受的剩余风险。
8.9 在无菌环境下配置的过程中、在所有工艺阶段(包括待包装产品灭菌之前和之后的阶段)、以及直至产品封装入最终容器中,都应按照工厂的CCS采取预防措施以最大程度减少微生物、热原和微粒污染。在洁净室应尽可能减少容易产生微粒和纤维的物料。
8.10 在可能的情况下,应考虑使用诸如RABS、隔离器或其它系统之类的设备,以减少对A级区的关键干预措施,并将污染风险降至最低。也可考虑机器人和工艺自动化,以消除直接的人为关键干预(例如干热隧道,冻干机自动装载,在线灭菌)。
8.11 表5给出了各级环境下执行的操作的示例。
表5.无菌制备和加工的操作及洁净级别的示例
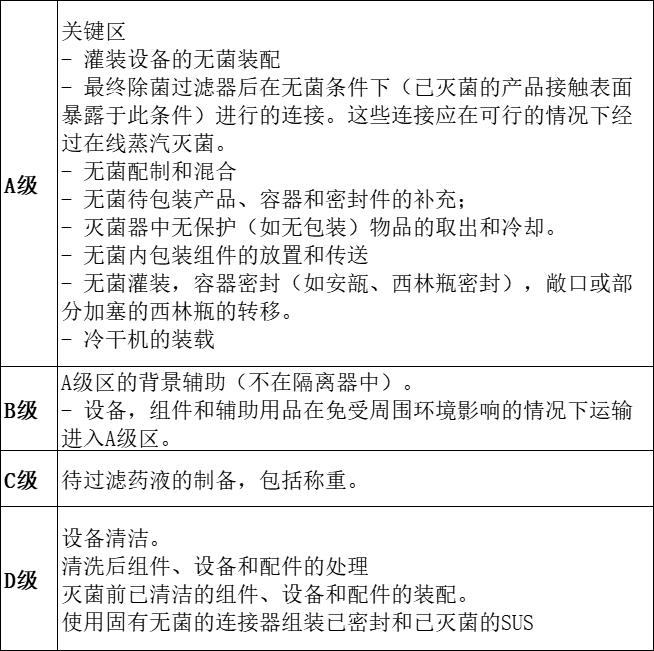
……
3. 优质内容推荐
3.1 优质资源
( 无菌工艺验证概要)
无菌工艺验证概要)
( 无菌生产工艺验证)
无菌生产工艺验证)
3.2 优秀文章
3.3 优质课程
欧盟无菌附录一解读


