2020年12月日,在官网以最后一个通告发布《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》((月日)起实施,此办法为促进化学药品注射剂的研究和评价工作,落实《中华人民共和国药品管理法》有关规定等文件精神,本文为大家梳理了化学药品注射剂灭菌和无菌工艺研究及验证指导原则》关键要点内容并结合自己的解读与大家分享。
一、注射剂灭菌
注射剂常用的灭菌是保证制剂质量和用药安全的关键步骤,合理且经过验证的注射剂常用的灭菌以及良好的无菌保证体系以是实现注射剂灭菌要求注射剂灭菌;多家做一致性评价的药企收到要求补充提供的工艺验证和灭菌工艺验证资料不全等补正通知。无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药。从严格意义上讲,无菌药品应不含任何活的微生物,但由于目前检验手段的局限性,绝对无菌的概念不能完全做到,目前只能确保是概率意义上的控制目标目前行业共识为:
Ø湿热灭菌工艺:不超过一百万分之一。
Ø无菌生产工艺:以培养基灌装零污染为目标。
二、湿热灭菌工艺研究和验证关键要点
1、湿热灭菌工艺研究关键要点
灭菌工艺的选择一般按照灭菌工艺选择的决策树进行,湿热灭菌工艺是决策树中首先考虑的灭菌方法。注射剂的湿热灭菌工艺应首选过度杀灭法,即
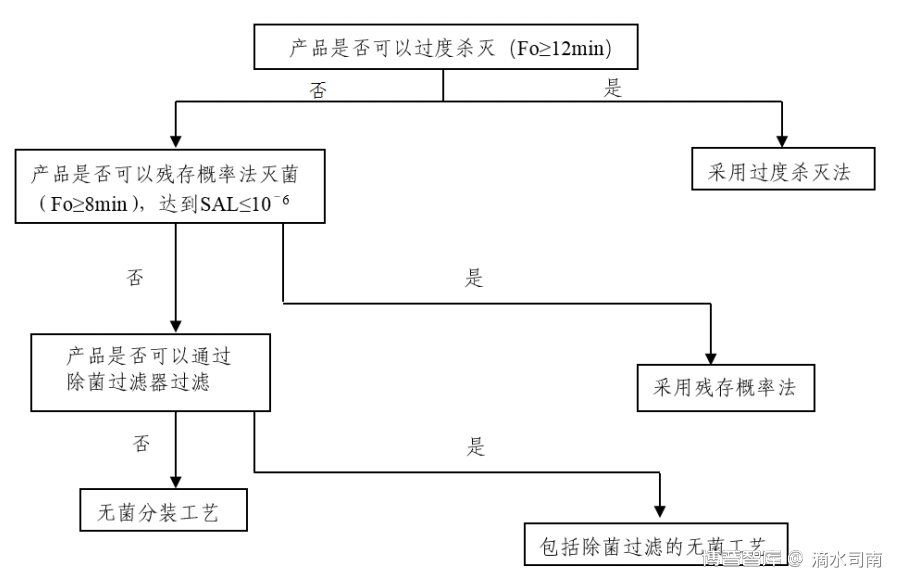
注射剂灭菌工艺选择的决策树
2、湿热灭菌工艺验证关键要点
灭菌工艺验证包括物理确认和生物确认两部分,物理确认包括热分布试验、热穿透试验等,生物学确认主要是微生物挑战试验。明确提出物理确认和生物学确认结果应一致,两者不能相互替代。基本上与美国灭菌工艺验证关键项目。

三、无菌生产工艺研究和验证关键要点
1、无菌生产工艺研究关键要点
如经充分的研究(包括处方工艺研究、质量控制研究等)证实产品无法耐受终端灭菌工艺,则可考虑能否通过除菌过滤工艺进行过滤除菌,如果可以,可采用包含除菌过滤的无菌工艺;如果不可以,则可考虑采用无菌分装的全无菌工艺。
2、无菌生产工艺验证关键要点
无菌生产工艺验证主要包括除菌过滤工艺验证及无菌工艺模拟试验。采用除菌过滤工艺的产品应进行除菌过滤工艺验证及无菌工艺模拟试验,采用无菌分装工艺的产品应进行无菌工艺模拟试验。
2.1除菌过滤工艺验证关键要点
笔者梳理了除菌过滤工艺验证关键要点,一般情况下,除菌过滤验证包含除菌过滤器本身的性能确认和过滤工艺验证两部分,两者很难互相替代,应独立完成。
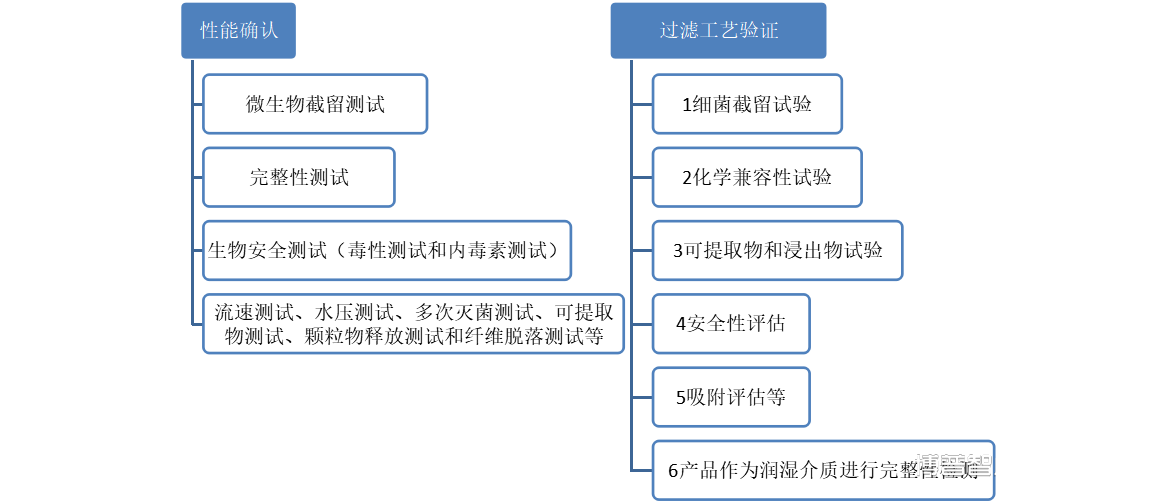
Ø除菌过滤器性能确认:一般由过滤器生产商完成,主要的确认项目包括微生物截留测试、完整性测试、生物安全测试(毒性测试和内毒素测试)、流速测试、水压测试、多次灭菌测试、可提取物测试、颗粒物释放测试和纤维脱落测试等。
Ø过滤工艺验证:是指针对具体的待过滤介质,结合特定的工艺条件而实施的验证过程,一般包括细菌截留试验、化学兼容性试验、可提取物或浸出物试验、安全性评估和吸附评估等内容。如果过滤后,以产品作为润湿介质进行完整性测试,还应进行相关的产品完整性测试验证。除菌过滤工艺验证可以由过滤器的使用者或委托试验检测机构完成,但过滤器使用者应最终保证实际生产过程中操作参数和允许的极值在验证时已被覆盖,并有相应证明文件。
2.2无菌工艺模拟试验关键要点
无菌工艺模拟试验是指采用适当的培养基或其他介质,模拟制剂生产中无菌操作的全过程,评价该工艺无菌保障水平的一系列活动。应结合产品特点及实际工艺中的最差条件,对相关验证试验进行合理设计,具体验证操作,包括模拟介质的选择与评价(培养基、其他介质)、灌装数量及容器的装量、最差条件的选择、培养方式、结果评价等,无菌工艺模拟试验关键要点梳理如下表:


参考文献
[1]www.cde.org.cn( www.cde.org.cn)
www.cde.org.cn)

