转发本文到朋友圈,添加微信 pckt6842免费领取【偏差管理】思维导图
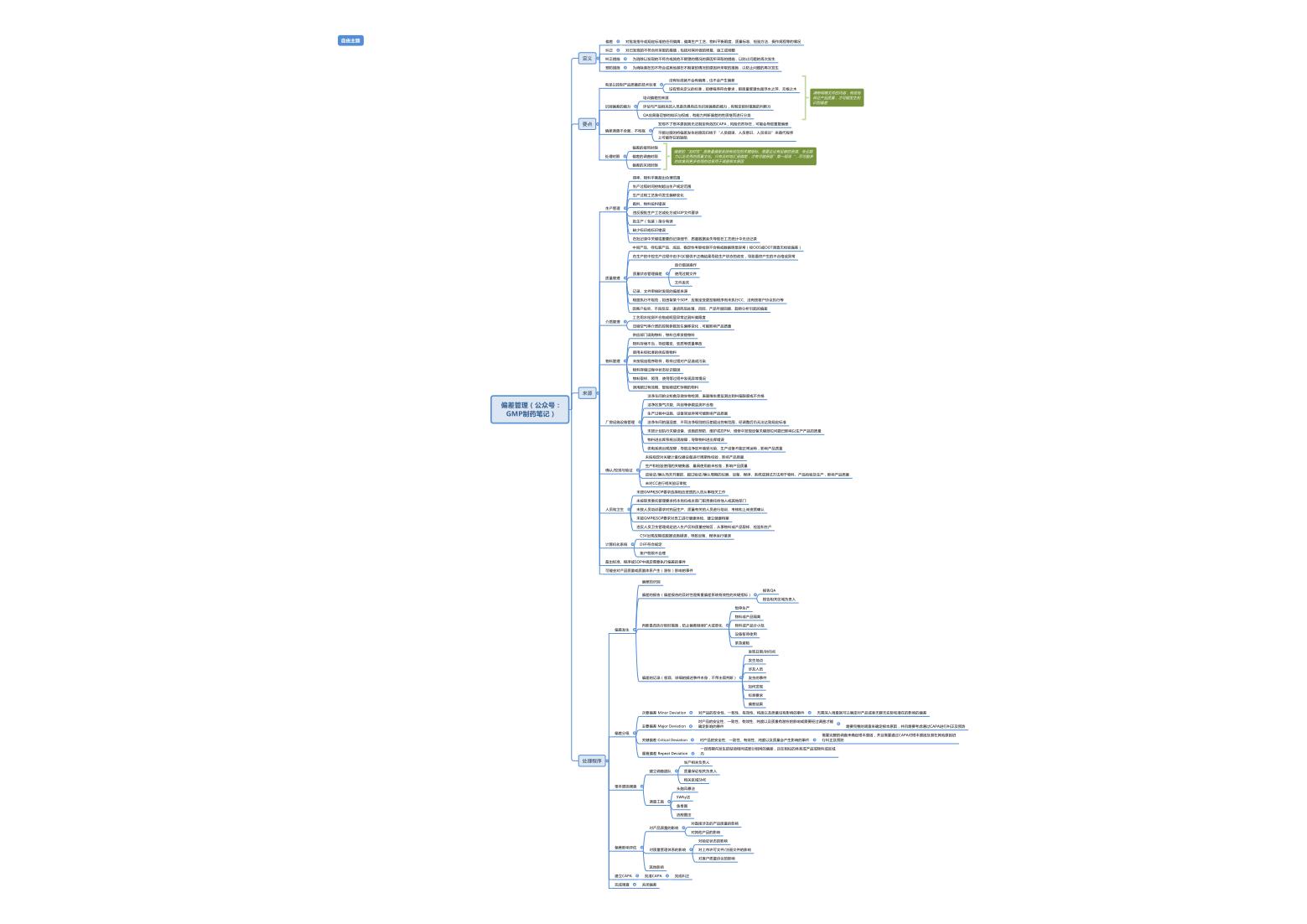
偏差概述:
偏差(Deviation),指偏离已批准的程序(指导文件)或标准的任何情况。
这里的“标准”是指药企为实现药品质量而建立的各种技术标准,包括但不局限于物料的分析检验标准。技术标准可以体现为各种文件形式,可以直接是程序文件的一部分,可以是独立的技术标准文件,也可以体现为受控模版或其它适当的形式。
这里的程序(指导文件,instruction)指广义“生产”(Manufacturing)活动的程序文件,偏离非“生产” 类的程序(例如仓储程序和试验室程序)也完全可能导致对产品质量的不良影响。
一般而言,偏离分析检验标准的情况通过OOS系统进行管理,偏离“生产” (Manufacturing) 的程序文件和其它技术标准的情况通过偏差系统进行管理。“偏差”定义的核心是“偏离”,GMP没有区分偏离程度的大小。 所有偏离程序或标准的情况都属于偏差的范畴。如果企业在程序中,对生产过程中可能出现的不同正常情况及其预先确定的操作方法进行了描述,则此种情况的出现就应视为正常操作的一部分。
相关法规:
中国GMP
第十章 质量控制与质量保证
第五节 偏差处理
第二百四十七条 各部门负责人应当确保所有人员正确执行生产工艺、质量标准、检验方法和操作规程,防止偏差的产生。
第二百四十八条 企业应当建立偏差处理的操作规程,规定偏差的报告、记录、调查、处理以及所采取的纠正措施,并有相应的记录。
第二百四十九条 任何偏差都应当评估其对产品质量的潜在影响。企业可以根据偏差的性质、范围、对产品质量潜在影响的程度将偏差分类(如重大、次要偏差),对重大偏差的评估还应当考虑是否需要对产品进行额外的检验以及对产品有效期的影响,必要时,应当对涉及重大偏差的产品进行稳定性考察。
第二百五十条 任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况均应当有记录,并立即报告主管人员及质量管理部门,应当有清楚的说明,重大偏差应当由质量管理部门会同其他部门进行彻底调查,并有调查报告。偏差调查报告应当由质量管理部门的指定人员审核并签字。
第二百五十一条 质量管理部门应当负责偏差的分类,保存偏差调查、处理的文件和记录。
FDA CFR 211 制剂成品的CGMP
Sec. 211.100 书面规程;偏差
(a) 应制订生产和工艺控制的书面规程,以保证药品具有所声称的或表明拥有的鉴别、规格、质量和纯度。 此类规程应包括该子部分中所有要求。这些书面规程(包括任何变更)应由相应的部门起草、审核和批准,并由质量管理部门进行审核和批准。
(b) 在进行不同的生产和工艺控制职能时应遵守制订的生产和工艺控制规程,并于当场做好记录。 任何偏离书面规程的偏差都应予以记录并作出合理解释。
Sec. 211.111 生产的时限
在适当情况下,应对生产的每一阶段设定时限,以确保药品质量。 在不影响药品质量的前提下,允许存在偏离既定时限的偏差。此类偏差应予以合理解释并记录。
Sec. 211.160 一般要求
(a)对本子部所要求制订的所有质量标准、标准、取样方案、检验规程或其它实验室控制机制,包括这些质量标准、标准、取样方案、检验规程或其它实验室控制机制的变更,应由合适的部门起草,并由质量管理部门审核和批准。应遵循本子部的要求并即时做好记录。所有偏离既定质量标准、标准、取样方案、检验程序或其它实验室控制机制的偏差,均应记录并作出合理解释。
Sec. 211.192 生产记录审核
在批放行或发运之前,所有药品生产与控制记录(包括包装与贴签)都应由质量管理部门进行审核和批准,以确定与所有既定的批准的书面规程的符合情况。不管该批是否已经发运,所有未解释的差异(包括超出生产与控制主记录中设定的最大或最小限度的理论收率)或一批或其任何原辅料不符合质量标准的情况,都应进行彻底调查。调查应扩大至相同药品的其它批次和与差异或不合格情况相关的其它药品。调查应作出书面记录并应包括结论和追踪情况。
FDA 制药企业CGMP规范的质量体系方法
4 不合格的处理
任何质量体系都会有一个关键的部分来处理不合格和/或偏差。调查、结论和后续措施都必须记录在案(§211.192)。为了确保产品符合要求和预期,按照计划测定工艺和产品特性(例如特定的控制参数、规格)是非常重要的。在生产过程的任何阶段或质量控制活动中都可能会发现偏差。不是所有的偏差都会导致产品缺陷,然而,重要的是要适当地记录和处理偏差。如果发现一个偏差影响到产品质量,那么偏差调查过程就非常关键了。
EU GMP Part I 通则
1.4 一个适当的制药质量体系应当确保:
ix. 在批次放行、偏差调査中考虑产品与过程监控的结果,以备采取预防措施以避免将来发生潜在偏差;
xiv. 在对偏差、可疑产品缺陷以及其他问题的调查中,应当运用适当程度的根本原因分析。可以使用质量风险管理原则来确定根本原因。如果不能确定问题的真实根本原因,则应当考虑识别出最可能的根本原因并予以解决。一旦怀疑或确定人为错误为根本原因,则应当予以评估,以确保没有忽略可能存在的工艺、规程或系统性的错误或问题。应当制定并实施适当的纠正和/ 或预防措施(CAPA ),作为对调查的答复。应当根据质量风险管理原则,对纠正和/或预防措施的有效性进行监督与评估。
1.8 药品生产质量管理规范的基本要求是:
vii. 所有重大偏差得到了完整记录、经过了根本原因调查并执行了适当的纠正与预防措施;
5.15 应当尽可能避免出现任何偏离工艺规程或操作规程的偏差。一旦出现偏差,应当由主管人员签字批准,必要时,质量控制部门参与处理。
5.44 对显著偏离预期产量的情况,应当记录并进行调査。
附录15 确认和验证
2.7 在实施期间,对已批准的方案进行任何重大变更,例如,可接受标准、操作参数等,均应记录为偏差并经过科学论证。
ICH Q7A 原料药的GMP指南
( ICH Q7)
ICH Q7)
2.16 记录并解释与已建立的规程的偏差,应调查关键的偏差,记录调查的过程和结果。
2.22 应设立独立的质量机构,其主要职责不得授权,应书面描述质量部门的职责,包括(但并不局限于)以下条款:4.确保重大的偏差得到调査和解决。
5.35 若重要仪器校验发现存在偏差,应对其进行调查研究以确定自最近一次的合格校验以来,这些偏差是否对中间体或API的质量有影响。
6.72 某个批次放行之前必须对其偏差记录,调查和不合格报告进行核对。
8.15 任何偏差都须记录并说明。任何重要的偏差均应调查。
WHO GMP 通则
16.Good practices in production
16.3 Any deviation from instructions or procedures should be avoided as far as possible. If deviations occur, they should be done in accordance with an approved procedure. The authorization of the deviation should be approved in writing by a designated person, with the involvement of the quality control department, when appropriate.
16.20 Any significant deviation from the expected yield should be recorded and investigated.
WHO 偏差处理和质量风险管理
4) Deviation handling
4.1 Event detection:4.2 Deviation Categorization4.3 Deviation Treatment4.4 Root cause investigation4.5 Corrective and Preventive Actions (CAPA)
资源推荐(点击链接查看):
资源专题
偏差管理相关资源文档
偏差调查&CAPA管理必备资料
优质文章
质量人必读偏差干货文章
「必读」偏差处理规程详细讲解
验证过程中的偏差,该怎么如何处理?
偏差、CAPA处理流程的要点解析!质量人必备!
课程
年度回顾中的偏差分析

