前言
偏差是指对批准的指令(生产工艺规程、岗位操作法和标准操作规程等)或规定的标准的偏离(1CHQ7a)。具体指在产品检验、生产、包装或存放过程中发生的任何偏离标准的规程、处方、质量标准、趋势、设备或参数的非计划差异。
偏差管理对于每个药企而言是十分重要的,因此本期将进行偏差处理规程进行相关讲解。
具体规程
1、目的
当产品、物料或系统不符合质量标准要求或某事件不符合相关文件或法规要求时,必须进行适当的调查,查明原因并采取必要的改正措施。
2、范围
本SOP适用于处理所有失误及非计划性故障事件,含概用于产品并控制产品的化学成分、包装材料、药品、工艺、系统、设备、公共设施和厂房等。
3、定义/缩写
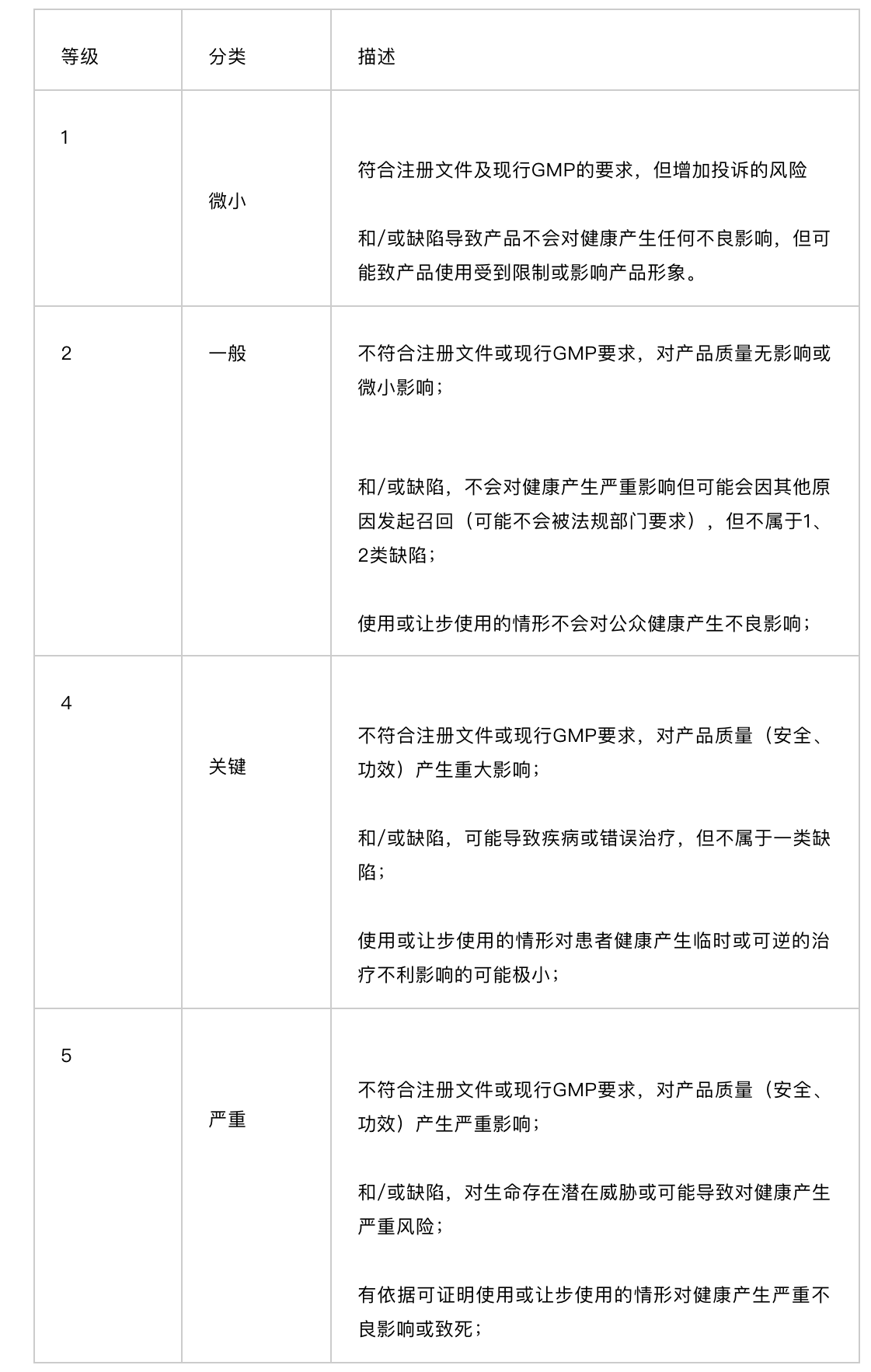
偏差(通常也称为异常):在药品生产过程中,任何与既定的程序、文件不符的非计划的变更或与批准的质量标准不符,或与GMP相关的系统失败。偏差按照对患者造成的风险何国家法规的符合性进行评估。偏差可分为三类“严重偏差、主要偏差、微小偏差”
严重偏差:
严重偏差需要立即进行调查,查找问题的根本原因并制定纠正预防措施。
主要偏差:
主要偏差需要进行调查,查找问题的根本原因并制定纠正预防措施。
非严重偏差可能潜在影响产品的质量、纯度、安全、功效或GMP法规的依从性。
微小偏差:
微小偏差需要调查,查找问题的根本原因并制定纠正预防措施。潜在影响GMP系统,公用设施,设备、物料、成分、环境或文件,但不影响产品的质量、纯度、安全、功效,不属于严重及主要偏差的缺陷。
偏差通常,但不绝对,发生在以下几个类别中:
确认的超出标准的测试结果
受控区域环境超标
不符合标准文件规定的操作(不符合标准操作规程的操作,生产、包装、贴标签或测试过程中操作参数的错误等)
影响产品质量的操作失误或设备故障
物料平衡或产率超过限度
物料在储存或处理过程中出现的损坏和污染情况。
活动未能按照计划进行(校准,预防性维护及稳定性试验等)
4、安全
无
5、程序5.1 责任
5.1.1 生产、物流、工程部、QC、HR经理
其职责为当那些可能导致潜在失误事件发生时,立即通知QA,并积极参与调查活动。
起草质量偏差报告
执行质量部经理批准的偏差改正措施。
确保本部门人员接受本SOP的培训并清楚所有需要报告的偏差。
5.1.2 质量部经理负责
确保本SOP始终符合集团及中国GMP的要求。
批准偏差的改正措施。
当发生批生产偏差时决定批次的处理。
如异常事件或偏差程度严重或其他工厂或下级合同商可能受到影响,工厂质量部经理负责与受影响的单位以及相关区域质量运营部进一步沟通。
对于影响到市场产品的严重偏差,按照“质量警戒的管理”,由质量部经理负责利用风险评估系统向IQC通报以确保类似严重偏差处理的一致性。
5.1.3 QA负责
确保每个偏差都进行了适当的调查,并按本SOP要求发放偏差报告。
保管登记所有偏差报告的日志。
将偏差报告存档
跟踪偏差报告确保它们及时结束。
至少每年进行一次当年所有偏差的审阅等。
5.1.4QC经理负责
确保按照SOPS-QC035报告实验结果发生的偏差。
进行调查所需的测试以配合查明原因或确定产品质量。
至少每年进行一次当年所有OOS的审阅并作趋势分析等。
5.1.5 所有人员负有如下责任
向部门主管或部门经理报告所有质量偏差。
如果偏差可能影响到HSE确保通知健康、安全、环境部门。
5.2质量偏差的报告
5.2.1划性偏差
计划性的偏差只能作为非常规的特例使用。
计划性的偏差一定要被质量部经理预先授权认可。
要求书面记录偏差的目的以及经质量部经理批准。
5.2.2 非计划性偏差
所有质量偏差必须立即向相关的部门主管或经理报告。
偏差发生部门负责起草质量偏差报告(见本SOP附件)
5.2.3 偏差处理的原则及方法
5.2.3.1偏差发起
以下方针用以协助报告的完成
1.发生偏差的部门的经理/主管或发现偏差的操作人员应填写第1、2、3、部分:
第1部分
- 部门名称
- 发现日期
- 发现者(姓名)
2:第2部分
若是产品偏差,记录发生的产品名称和批号;如果是设备误差,记录设备名称;如果是影响到公共设施的偏差,记录受影响的公共设施的名称。3:第3部分
报告偏差发现后采取的每一个部门经理或主管批准的紧急措施。5.2.3.2 偏差的评估
填写第4部分并在日志中登记。
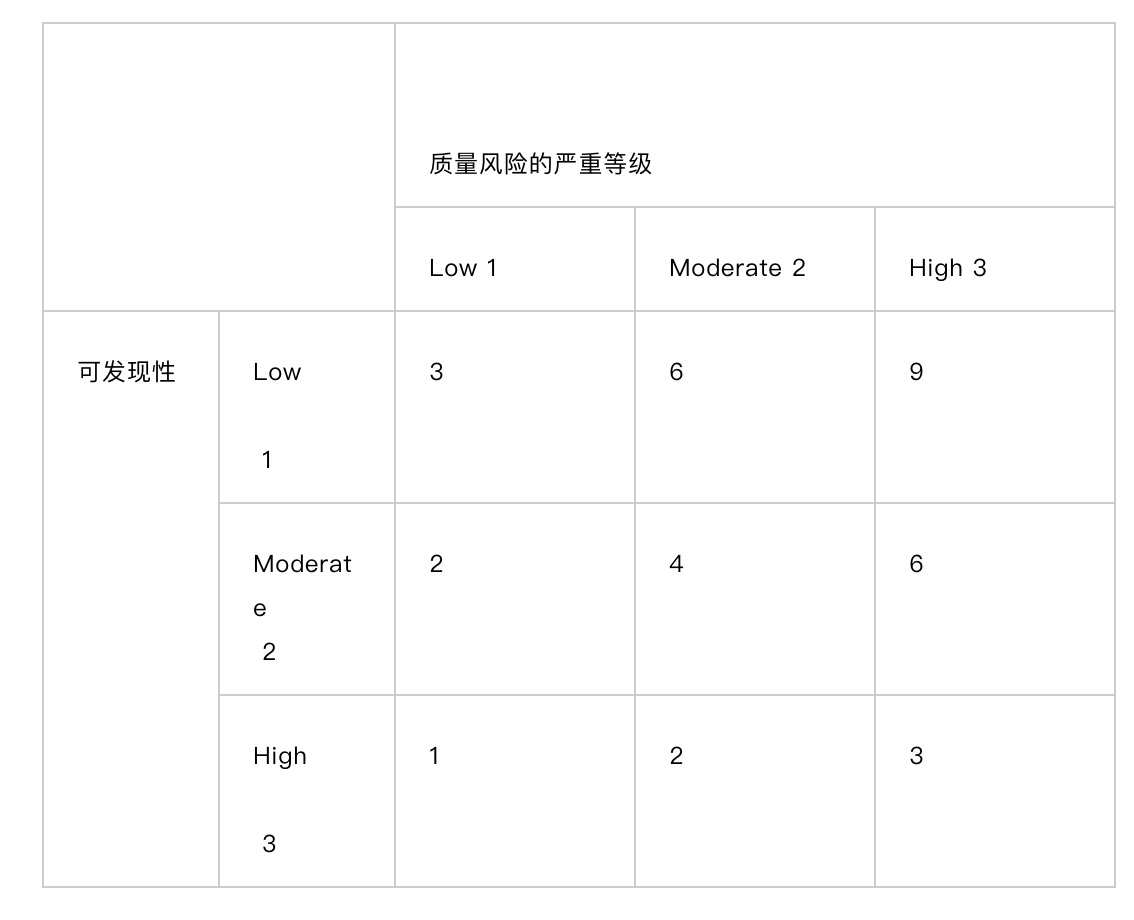
可能性分类如下:
质量风险严重等级来自于缺陷的严重性及发生的可能性的乘积,结论见下表:
根据上表,质量风险严重等级为:
如果乘积小于4(绿色区域)为低;
如果乘积大于3而小于10(黄色区域)为中;
如果乘积大于8(红色区域)为高;
可发现性分类如下:

当调查结束后部门经理应在第5部分填写对调查和紧急措施的评价,如果偏差与产品有关,QA同时做出批次处理决定。5.2.3.3 纠正预防措施5.3 偏差报告的存档5.4 差报告的回顾
批偏差必须记录在年度产品回顾中。
QA至少每年一次对所有的偏差报告进行总结。内容可以包括对偏差修正活动有效性进行分析、以及对问题的再次发生进行探察等。6.附件7. 改版记录

附录1
质量偏差报告

(3) 事件和紧急措施描述
(5)调查和评价

(6) 建议的改正措施

(7) 改正措施的执行

(8)改正措施的评价及完成批准

附件2:SOP培训记录
SOP标题:质量偏差管理
SOP编号:下列人员已接受本标准操作规程内容的培训。以下的签字表明受训者承认已接受了培训并理解。
部门名称培训者姓名培训日期受训者签名

[1]《药品质量生产管理规范》2010修订版
制药路上学习是永不能停歇的!٩(๑❛ᴗ❛๑)۶
以上内容为博普智库收集整理,如需要转载或有相关问题请与小编联系;
转载需表明来源!

