5 生产过程控制
口服固体制剂常见剂型有片剂、胶囊剂、颗粒剂,剂型不同,工艺不同,所涉及的操作单元不同,常规操作单元一般为配料、制粒(湿法制粒、干法制粒、热熔挤出制粒等)、干燥、整粒、混合、压片、包衣(片剂包衣、微丸包衣)、胶囊填充、内外包装等,其中胶囊剂包括硬胶囊剂和软胶囊剂,软胶囊的操作单元有别于其他固体制剂操作单元,通常为:配料、溶胶、压丸、干燥、拣丸、洗丸、印字、内外包装等。
本章节着重介绍固体制剂单元操作所涉及的技术要点、关键过程参数以及各操作单元生产过程的质量控制,以保障持续稳定地生产出符合预期质量要求的药品。
法规要求
药品生产质量管理规范(2010年修订)
第一百一十五条 应当由指定人员按照操作规程进行配料,核对物料后,精确称量或计量,并作好标识。
第一百一十六条 配制的每一物料及其重量或体积应当由他人独立进行复核,并有复核记录。
第一百一十七条 用于同一批药品生产的所有配料应当集中存放,并作好标识。
第一百二十一条 包装材料应当由专人按照操作规程发放,并采取措施避免混淆和差错,确保用于药品生产的包装材料正确无误。
第一百二十四条 印刷包装材料应当设置专门区域妥善存放,未经批准人员不得进入。切割式标签或其他散装印刷包装材料应当分别置于密闭容器内储运,以防混淆。
第一百二十五条 印刷包装材料应当由专人保管,并按照操作规程和需求量发放。
第一百二十六条 每批或每次发放的与药品直接接触的包装材料或印刷包装材料,均应当有识别标志,标明所用产品的名称和批号。
第一百八十四条 所有药品的生产和包装均应当按照批准的工艺规程和操作规程进行操作并有相关记录,以确保药品达到规定的质量标准,并符合药品生产许可和注册批准的要求。
第一百八十九条 在生产的每一阶段,应当保护产品和物料免受微生物和其他污染。
第一百九十条 在干燥物料或产品,尤其是高活性、高毒性或高致敏性物料或产品的生产过程中,应当采取特措施,防止粉尘的产生和扩散。
第一百九十七条 生产过程中应当尽可能采取措施,防止污染和交叉污染。
第二百零二条 包装操作规程应当规定降低污染和交叉污染、混淆或差错风险的措施。
第二百零三条 包装开始前应当进行检查,确保工作场所、包装生产线、印刷机及其他设备已处于清洁或待用状态,无上批遗留的产品、文件或与本批产品包装无关的物料。检查结果应当有记录。
第二百零四条 包装操作前,还应当检查所领用的包装材料正确无误,核对待包装产品和所用包装材料的名称、规格、数量、质量状态,且与工艺规程相符。
第二百零五条 每一包装操作场所或包装生产线,应当有标识标明包装中的产品名称、规格、批号和批量的生产状态。
第二百零六条 有数条包装线同时进行包装时,应当采取隔离或其他有效防止污染、交叉污染或混淆的措施。
第二百零七条 待用分装容器在分装前应当保持清洁,避免容器中有玻璃碎屑、金属颗粒等污染物。
第二百零八条 产品分装、封口后应当及时贴签。未能及时贴签时,应当按照相关的操作规程操作,避免发生混淆或贴错标签等差错。
第二百零九条 单独打印或包装过程中在线打印的信息(如产品批号或有效期)均应当进行检查,确保其正确无误,并予以记录。如手工打印,应当增加检查频次。
第二百一十条 使用切割式标签或在包装线以外单独打印标签,应当采取专门措施,防止混淆。
第二百一十一条 应当对电子读码机、标签计数器或其他类似装置的功能进行检查,确保其准确运行:检查应当有记录。
第二百一十二条 包装材料上印刷或模压的内容应当清晰,不易褪色和擦除。
第二百一十三条 包装期间,产品的中间控制检查应当至少包括下述内容:
(一) 包装外观;
(=)包装是否完整;
(三)产品和包装材料是否正确;
(四)打印信息是否正确;
(五)在线监控装置的功能是否正常。
样品从包装生产线取走后不应当再返还,以防止产品混淆或污染。
第二百一十五条 在物料平衡检查中,发现待包装产品、印刷包装材料以及成品数量有显著差异时,应当进行调查,未得出结论前,成品不得放行。
第二百一十六条 包装结束时,已打印批号的剩余包装材料应当由专人负责全部计数销毁,并有记录。如将未打印批号的印刷包装材料退库,应当按照操作规程执行。
另外主要参考以下 GMP 相关章节内容:
• PICIS GMP Chapter 5- Production(第五章 生产)
• 美国 CFR 211-F Production & Process Control(生产与过程控制)
• 美国 CFR 211G Packaging &Labeling Control(包材与标签控制)
• 欧盟 GMP Chapter 5 Production(第五章 生产)
5.1 过程操作单元
5.1.1 配料
背景介绍
配料是口服固体制剂生产过程中的第一个步骤,按处方量精确称量每个物料,是生产出符合预定用途和注册要求药品的前提。
技术要求
新建厂房建议中央配料区域设置在靠近库房的区域,以减少物料的转运。根据生产设施的产能,工厂可能需要一个或多个称量和配料单元。生产多种产品的工厂,可以设置不同产品专属的配料单元,如液体配料区、防爆配料区。
专属配料区应与生产区域相连接,使得被配好的物料直接通过洁净走廊,供应生产使用。
配料区域和其他后续工序的生产房间一样,也要按照 GMP 的要求建造和运行。
由于在这个过程可能需要操作特殊性质(如:高致敏性、高活性、B-内酰胺结构类、性激素类、某些激素类、细胞毒类等)的物料,所以密闭隔离、人员安全保护、员工暴路操作防护和可清洁性是配料设备和配料区域设计要考虑的关键因素。配料区所使用的密闭隔离装置和设备应根据物料的危险级别和配料方法设置。
称量操作对环境的要求反映了该步骤的重要性。除了对于布局、设备和厂房表面光滑度、完整性、密封性的要求,房间也应该独立于生产区域的其他房间。在规划阶段,称量地点就应该根据既定的物流和人流来确定。因此不建议将称量固定在多功能房间进行。作为称量系统必须非常精确地按物料平衡和流程定义,以防止交叉污染和混淆。
为了避免交叉污染,配料原则上是先称量无粉尘辅料,再称量可能产尘辅料,最后称量原料;在上述原则基础上,应先称量白色、类白色物料,再称量其他颜色物料。
称量时应选用合适量程和精度的称量仪器,以确保称量的准确性。
A.手动配料
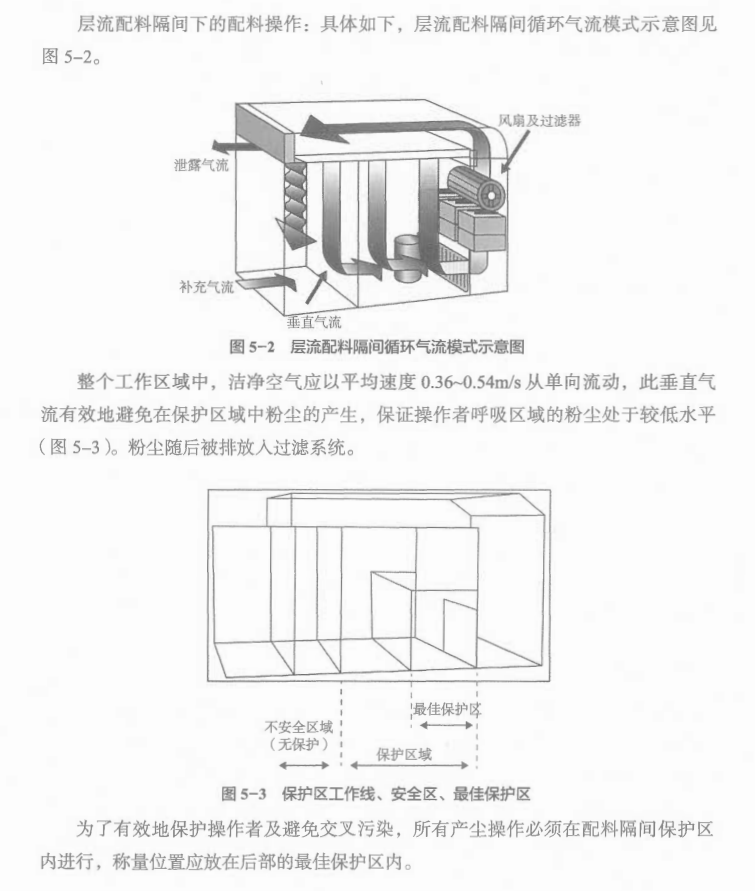
在开放环境下手动配料将会导致粉尘浓度达到或超过职业暴簬限值,增加交叉污染的风险。因此,典型的方法是在单向层流装置中进行配料称量。同一时间内,只允许一种物料进行称量操作。
对于特殊性质的物料(如:高致敏性、高活性、内酰胺结构类、性激素类、某些激素类、细胞毒类等),应考虑在隔离装置(如手套箱)中进行物料称量。隔离装置可以是固定的,也可以是可移动的,该装置装有高效过滤器和位置合适的手套式操作口。容器或者物料桶可以使用称量隔离装置直接被装料,但是这需要一个提升平台使物料桶位于下方,或者隔离装置可以被安装在物料桶装料区域之上的楼层。
物料通过缓冲间需要被仔细的评估,在称量和配料操作过程中,高级别的密闭隔离,需要考虑产品和人员均被防护到位。当处理这类危险级别高的原料时,可以使用人员缓冲间使这些区域分开,而且也可以设定专门的更衣程序。
B. 自动配料
自动称配系统,通常是基于软、硬件控制,使物料从储料容器中被卸载并以受控的方式进入接收容器,在接收容器中物料被称量。这种系统需要把物料从各自的原容器中转移到储料器中,通常使用重力卸载或者气动输送。这种受控的物料输送可能包括螺旋杆输送、旋转阀门或脉动开关阀门的使用,物料被收集在一个可以称量的容器中,当所需重量的物料被分配到接收容器时,下料系统会停止。自动称配系统在设计时要考虑称量准确可靠、数据可靠性以及如何避免污染和交叉污染。
C.生产过程
a. 检查准备
检查房间温湿度符合要求,房间设施清清消毒在效期内,无与该配料操作无关的物料、文件等。
检查层流罩或隔离器功能正常,并空机运行,压差、风速符合要求;确认使用到的衡器功能正常且在校验效期内,并进行了日常校准。
领取物料并核对物料名称、批号、数量和质量状态等信息,重点关注储存条件特殊的物料,确保环境不会对物料造成不良影响。
领取配料用的物品,如容器、物料勺等,确保使用前是清净状态。
b. 配料
物料的称量顺序应按规定的原则进行,以降低交叉污染的风险;严格按注册批准工艺所描述的处方用量进行称量;配料过程需要由第二人进行复核,确保物料品种和数量正确、标签正确、密封完好。
称量前后物料均应有明确标识,标明名称、批号、数量等。
配料过程中,接触物料的已清洁工具一次只能用于一种物料,避免混用。
c.暂存退回
称量后物料按产品批次或物料批次摆放暂存,物料应与产品相关联,暂存过程需关注物料存储条件的符合性。称量剩余物料应核实名称、批号、数量和物料平衡等关键信息后,贴好物料标签,密封好后退回至领取点。
d. 清场
按规程对所用到的区域及设备设施等进行清洁。
要点备忘
• 配料所使用的称量衡器应满足精度及准确度要求,并定期校验。
配料前应按配料指令单核对物料标签的信息,包括物料名称、物料编号、批号、有效期及质量状态等。
配料时,先配无尘辅料,再配可能产尘辅料,最后配原料;在上述基础上先配白色、类白色物料,再配其他颜色物料。
• 配料过程中,工具一次只能用于一种物料,不能混用。
• 物料称量过程必须由他人复核,确保所称物料名称、数量正确。
实例分析
某工厂配料区域与操作实例:某工厂配料区域的房间布局图见图5-1。

5.1.2 制粒/干燥 / 整粒
虽然制粒、干燥、整粒可作为独立的操作单元,但在湿法制粒工艺中3个操作单元通常为同一工序的3个连续操作步骤,因此在本章节中将对3个操作单元合并介绍。
5.1.2.1 制粒
背景介绍
制粒是把粉末聚结成具有一定形状与大小的颗粒的操作。此过程有改善物料流动性、可压性,提高原料的混合均匀度,防止粉尘暴露等作用。
制粒通常分为湿法制粒和干法制粒两种应用最广的制药技术。近年来,热熔挤出制粒技术也逐渐得到应用,其有利于提高活性成分的溶解度,从而提高其生物利用度,也可掩盖活性成分的不良气味,增加制剂的稳定性。
技术要求
湿法制粒物料的粒径大小、粒径分布、形态、表面积、在黏合剂中的溶解度、制粒过程中表面被黏合剂润湿的程度都可能影响制粒的工艺和颗粒的质量,进而影响产品的质量。合适的颗粒粒径大小、粒径分布、颗粒密度、可压性、流动性、水分是湿法制粒成功的重要体现。
干法制粒是将药物和辅料的粉末混合均匀,通过机械力压缩成片状、板状或硬条状,再粉碎成所需大小颗粒的制粒方法,常见的压饼方法有压片法和辊压法。干法制粒用物料应具有良好的流动性和压缩成型性。干法制粒的生产周期短,生产效率高,有利于提高药物的稳定性。
热熔挤出技术是利用挤出机将原料均匀分散于聚合物载体的连续制粒工艺。热熔挤出过程中,原料和载体以及各种辅料加入挤出机后,在挤出机的机械力及机筒外加热量的作用下,首先将物料熔融,然后进行分布和分散混合,使原料及各种辅料均匀分散于载体中,再进一步进行脱挥操作,最后由挤出机螺杆将物料从机头挤出。在热熔挤出工艺中,选择合适的载体至关重要。载体应具备良好的热稳定性和热塑性,与原料相容性好。载体的空隙和微孔结构对药物的释放速度有明显的影响。
热熔挤出处方中常常通过加入增塑剂,以降低载体的玻璃态转化温度,增加原料的润湿性,增加挤出物的孔隙率及释药表面积,改善药物释放。
A.湿法制粒
a. 高速搅拌制粒
将原料、辅料和黏合剂加入制粒锅中,靠高速旋转的搅拌器的搅拌作用和切碎器的切割作用迅速完成混合并制成颗粒的方法。高速混合制粒机的形状多种多样,其结构主要由容器、搅拌桨、切割刀组成。操作时先把原料和各种辅料倒入容器中,加盖,把物料搅拌混合均匀后加人黏合剂,搅拌制粒。完成制粒后倾倒颗粒或打开安装位于底部的出料口自动放出湿颗粒,对湿颗粒进行整粒,将大团块打散,然后进行干燥,干燥结束后对干颗粒进行过筛整粒。
物料加入和转出高速混合制粒机的方式与设备的布局相关。手工上料会产生大量的粉尘。如果可能,可以用物料桶或管道连接,采用真空吸料。使用高速混合制粒机还需要考虑的是配制和加入黏合剂,并且实现自动化控制这些操作。
由于制粒过程比较复杂,影响制粒效果的因素比较多,如大量的操作参数、原料的占比、物料粒径分布、物料密度等。因此,通常的做法是固定一些操作参数:
如干混的时间、搅拌桨转速、黏合剂加入量,同时允许有限的几个参数在规定的范围内调整,至达到制粒终点的控制要求。例如湿混时,湿混时间可以不固定,监控搅拌桨的负荷(如扭矩、电流值),当其达到一定的值即指示制粒终点的到达。
高速搅拌制粒的关键控制点一般有加液速度、搅拌桨速度、制粒时间。加液速度越慢,物料接触黏合剂越充分,颗粒越均匀,但可能导致颗粒变硬,影响颗粒可压性;搅拌桨速度越快,制粒时间越长,颗粒越大越硬。
b.挤压制粒
挤压制粒分挤压制粒和挤出滚圆制粒两种。两种制粒方式操作过程类似,挤压制粒操作过程一般为:原料、辅料混合一捏合(制软材)一挤压制粒干燥一整粒。
挤出滚圆制粒操作过程一般为:原料、辅料混合一捏合(制软材)一挤压制粒/成条状一滚圆-干燥。制粒设备有螺旋挤压式、旋转挤压式、摇摆挤压式、螺杆挤出机、滚圆机等。
制软材过程与高速搅拌制粒制软材过程一致。挤压制粒的方式有很多种,但其原理相同,即软材在外力的作用下通过筛网或辊子。在干颗粒特性和黏合剂类型一定的情况下,黏合剂的加人量、加人方式及速度,混合时间,桨转速,桨叶的形状就成为影响软材质量的关键。
颗粒的大小取决于筛网的孔径或挤压轮上的孔径大小。孔径越小,颗粒的密度越大。制软材加液量也影响颗粒的密度,加液量越多,颗粒密度越大。颗粒密度大小影响压片工序或胶囊填充等工序,也会影响药品的溶出度/ 释放度。
关键控制点一般有加液速度、挤压力度、筛网/挤出板孔径和滚圆时间等。加液速度越慢,物料接触黏合剂越充分,颗粒越均匀,但可能导致颗粒变硬;挤压力度越大,孔径越小,颗粒越硬;滚圆时间越长,颗粒越圆整,但硬度越硬。
c.流化床制粒
使混合粉体在自下而上的气流作用下保持悬浮的流化状态,黏合剂液体向流化层喷入使混合粉末聚结成颗粒的方法。由于在同一台设备内完成混合、制粒、干燥整个过程,又称一步制粒。主要结构有进风系统、流化床锅体、气体分布装置(如筛板)、喷液系统、排风系统。操作时,把药物粉末与各种辅料加入流化床内,从床层底下通过筛板吹人适宜温度的气流,使物料在流化状态下混合均匀,然后开始喷入黏合剂,粉末开始聚结成粒,经过连续喷雾和干燥,当黏合剂喷完后,制粒结束,形成的颗粒继续在床层内送热风干燥,到达干燥终点后出料并进行过筛整粒。
在流化床制粒机中,干粉和黏合剂接触制粒。根据喷枪安装位置不同,主要有三种工艺:顶喷、底喷和切线喷,其中流化床制粒主要采用顶喷工艺。
通过配置不同的配件,流化床制粒机可以制造满足预定用途的颗粒。例如,增加搅拌转动功能的流化床,由于粒子做环形运动,制出的颗粒比传统的顶端喷雾制粒流化床密度要稍大,更圆更光滑。
在流化床制粒中,物料粉末靠黏合剂的架桥作用相互聚结成粒。制粒时影响因素较多,除了黏合剂的选择,原料粒度的影响外,操作参数的影响较大。如进风量影响物料的流化状态、粉体颗粒的分散性、干燥的快慢;进风温度影响物料表面的润湿与干燥;雾化压力影响粒径的大小;喷雾速度影响粉体粒子间的结合速度及粒径大小和均匀性;喷嘴的高度影响喷雾的均匀性和润湿程度。
流化床制粒的关键控制点一般有加液速度、物料温度、雾化压力和进风量。加液速度越慢,物料接触黏合剂越充分,颗粒越均匀,但太慢会导致过度喷雾干燥,影响颗粒成粒,细粉变多;通过物料温度监控流化床内湿热平衡状态,温度太低,流化床内湿度大,容易造成塌床;雾化压力主要用于将黏合剂雾化成小液滴,雾化压力越大,液滴越小,成粒越均匀,雾化压力过大也会造成喷雾干燥现象;风量起到流化物料和干燥作用,风量越大,带走水分越快,干燥效果越好,风量过大可能会影响收率。颗粒的质量对后续工序如压片工艺的成功有重要的影响。应用 PAT来控制制粒工艺是很有帮助的,如近红外全光谱在线检测水分,颗粒特征分析仪在线检测制粒过程不同阶段颗粒的大小和分布,借此可判断制粒终点。
d. 喷雾制粒
喷雾制粒是将药物溶液或混悬液用雾化器喷雾于干燥室内的热气流中,使溶剂迅速蒸发以直接制成球状干燥细颗粒的方法。该法在数秒钟内即完成原料液的浓缩、干燥、制粒的过程,原料液含水量可达70%~80%以上。喷雾制粒过程为:原料液由储槽进人雾化器喷成液滴分散于热气流中,空气经蒸汽加热器或电加热器进入干燥室与液滴接触,液滴中的水分迅速蒸发,液滴经干燥后形成固体粉末落于器底,干品可连续或间歇出料,废气由干燥室下方的出口流人旋风分离器,进一步分离出固体粉末,然后经风机和袋滤器后排出。
喷雾制粒中,原料液在干燥室内喷雾成微小颗粒液滴是靠雾化器完成,因此雾化器是喷雾干燥制粒机的关键部件。常用的雾化器有压力式雾化器、气流式雾化器、离心式雾化器。
雾滴的干燥情况与热气流及雾滴的流向有关。流向有并流型和逆流型,其中并流型较常见。并流型使热气流与雾滴并流进干燥室,颗粒与较低温的气流接触,适用于热敏物料的制粒,且制得颗粒大小较均匀。逆流型使热气流与雾滴逆流进入干燥室,干燥颗粒与温度较高的热风接触,物料在干燥室内的悬浮时间较长,干燥效果好,制得的颗粒粒径分布较广。
关键控制点一般有加液速度、物料温度、雾化压力、风量。这些因素相互作用,影响颗粒的粒径大小、表面形态和密度等。
B. 干法制粒
干法制粒常用于热敏性物料、遇水易分解的药物以及容易压缩成形的药物的制粒。
a.压片法制粒
是将待制粒的原辅料混合均匀,压制成大直径的片(块)状,再经过规定大小的筛网进行粉碎和挤碎,即得颗粒。
压片法制粒的关键控制点一般有压力、粉碎刀速度和筛网孔径大小。压力越大,压成饼后颗粒的可压性变差,最终影响崩解时限;粉碎刀速度和筛网孔径共同决定了制得颗粒的大小。
b.辊压法制粒
辊压法制粒其颗粒性质的优化程度就是颗粒的可压缩程度。为降低辊压工艺对再压制能力的损害,尽量使用仅满足粉料密度化所需最低的压力。
可能影响薄片形成以及颗粒特性的关键参数有:辊压压力、滚轮间隙、进料速度、粉碎刀速度和筛网孔径。粉体应保持稳定地进料,不稳定的进料速度导致饼的密度不均匀,最终会影响粉碎后颗粒大小、粒径分布与其堆密度和硬度。
辊压区内,根据自动模式的不同,典型的控制方式有:
• 设定压力恒定值,固定缝宽,自动调节进料速度以维持压力/缝隙宽度。
• 设定压力恒定值,固定进料速度下,自动调节缝隙宽度以维持压力设定。
针对密度小的粉料,若螺杆强制进料很难确保稳定进料时,可考虑在进料过程增加真空吸气,在粉料进入辊压步骤前,将粉料中锁住的空气抽出,使得粉料密度增大,从而确保粉料能稳定进料,所以真空吸气是另外一种能确保粉料均衡进料的方式。
在辊压区内,粉料被高密度化,粉粒被挤压变形或者变碎,最后辊压缝最窄处形成薄片。此时,可以通过控制辊压压力、真空压力和稳定进料,来控制薄片密度,再通过粉碎刀和筛网来控制最终颗粒的粒径。
C. 热熔挤出制粒
热熔挤出处方中一般含增塑剂,使得聚合物变软并增加其柔韧性,以此来改善工艺条件。
热熔挤出制粒关键控制参数包括螺杆转速、进料速度、温度等。进料速度和螺杆速度是一组相关联的参数,加料速度相比于螺杆转速过快,会引起加料口物料堆积,而不能连续操作;螺杆转速相比于进料速度过快,物料在机筒中有效填充率偏低。两者共同决定了物料在机筒中的停留时间,停留时间过短会导致物料熔融、混合不充分;停留时间过长会使物料降解加剧。温度是物料改性和成型的关键因素,也是物料热稳定的关键因素。挤出温度可以进行分段控制,一般熔融区温度略高于混合物的玻璃态转化温度;加料口温度一般需要较低的温度控制,避免高温区热传递导致加料口物料熔融,出现加料口物料软化堆积现象;口模的温度控制决定物料挤出形态和压力。
热熔挤出完成后,条状物一般需进行粉碎,将条状物粉碎至所需大小的颗粒,常用的粉碎方式主要是机械粉碎,如万能粉碎机、锤式粉碎机等。粉碎过程,粉碎机粉碎刀转速、筛网孔径大小对粒径大小影响较大,粉碎刀越快,筛网网孔越小,粉碎后的颗粒的粒径越小。
要点备忘
•制粒是产尘过程,操作应尽量保持密闭,房间应保持相对负压,并采用直接排风。
•制粒过筛操作前后应检查筛网的完整性,生产用到的过滤器、过滤袋、连接管道(必要时)等难清洁部件应明确标识,按活性成分专用。
• 投料前应检查物料的名称、编号、重量等信息,并建议由他人进行复核,确保正确投料,按规定的顺序依次加入物料。
• 应对制粒液制定合理的存储效期,并在规定的存储效期内使用。
• 制粒液如使用到有机溶剂,需要关注安全和环境风险,应采取相应措施控制风险。
5.1.2.2 千燥/整粒
背景介绍
干燥是利用热能使湿颗粒中的溶剂汽化,并利用气流或真空带走汽化的溶剂,从而达到去除制粒溶剂的目的。产品中湿分多为水分,带走湿分的气流一般为空气。
在固体制剂生产过程中需要使用到干燥工艺的多为湿法制粒产品。
使湿分汽化的加热方式有:热传导加热、对流加热、热辐射加热、介电加热等,对应的干燥设备有:厢式干燥器、流化床干燥器、红外干燥器、微波干燥器,其中厢式干燥器和流化床干燥器为固体制剂中最常用的干燥设备。
厢式干燥器产品损耗少,主要适用于少量物料的干燥,如产品研发阶段,当原料用量很少又很贵重时。厢式干燥器是一种静态的干燥过程,于燥时间较长,效率较低。将产品从物料盘中转移出来应采取措施避免产生大量粉尘。
流化床干燥在口服固体制剂颗粒的干燥中应用广泛。此种干燥是使空气自下而上通过松散的粒状或粉状物料层形成“沸腾床”而进行的干燥操作,它是—种动态的干燥过程,于燥效率高。流化床干燥器干燥产品时,将产品由加料器送入干燥器内的多孔气体分布板(筛板)上,经过加热的空气吹人流化床底部的筛板充分与物料接触,热量由空气传入到颗粒中,进而将液体转化成蒸汽,在产品呈悬浮状态并上下翻动的过程中得到干燥。干燥后的产品由卸料口排出,废气经过滤袋或旋风分离器,夹带的粉尘被截留,废弃经排风系统排出。流化床干燥器干燥效率高,适用于干燥热敏性物料,但不适用于含水量高、易黏结成团的产品干燥。流化床可采用真空卸料,避免操作过程中粉尘暴露,还可配备在线清洗功能,避免清洁过程中操作者接触大量粉尘。
技术要求
A. 厢式干燥
厢式干燥器按照干燥方法分类,可分为两种。一种厢式干燥器是采用尾气循环法,将部分从干燥室排出的空气与新鲜空气混合重新进入干燥室。设备的热效率较高,同时还可调节空气的湿度以防止产品发生龟裂和变形。还有一种是中间加热法,即干燥室内装有加热器,使空气每通过一次产品盘再次得到加热,可保证室内上、下层干燥盘内产品干燥均匀。对于大多数固体制剂产品,干燥温度最高60C即可达到干燥效果。干燥器配温控功能,厢式干燥器有电加热和蒸汽加热两种方式,这两种方式常用于不易燃湿分的干燥。
B. 流化床干燥
流化床主要由流化床床体、气体分布装置(如筛板等)、气固分离装置(如袋滤器等)、进风系统、排风系统,物料排出口等组成。
流化床干燥器的底部是一个有孔的板或者气体分散的盘,使空气均匀的接触到产品层。也可以将底部板上的孔做成一定的角度以控制气流的方向。
进风经过加热,一般经过初、中、高三级过滤器,确保进风是洁净的。干燥过程受环境温度和湿度的影响。所以,如果控制进风的湿度,干燥过程的重复性会得到提高。
由于经过流化床的气流非常大,所以产品中的细小颗粒有从过滤器泄露的风险,干燥器的出风处应装有除尘装置和防止倒灌的蝶阀密闭。
干燥器中应有气固分离装置(如袋滤器),可截住产品颗粒,同时允许空气穿过。典型的流化床干燥器应可以截住 95%直径在5um 的颗粒。传统的干燥器是靠滤袋的机械抖动来收集截住的产品。现在也有用不锈钢过滤器的趋势,此种过滤器一般用预先打好孔的不锈钢滤芯,通常用反吹的压缩空气将过滤器上的产品吹落。在过滤器的下游配有风机(此种方式可避免扇叶上有粉尘残留),在干燥器体内创造了负压的环境,保证最少量的粉尘泄露。
C. 整粒
一般湿颗粒和干燥后的颗粒,需进行过筛整粒,对较大的团块和颗粒进行打散破碎,使颗粒粒径大小更均匀。
整粒机关键部件为转子和筛网,转子一般分圆刀型和方刀型,筛网除孔径大小外,还有不同的形状,如圆形、方形、鱼鳞形。一般湿颗粒整粒,选用方形孔筛网;
硬度比较大的干颗粒,选用方刀型转子和鱼鳞形筛网搭配使用,使得颗粒更容易被破碎。
整粒的关键控制参数有转子速度和筛网孔径,两者共同决定过筛整粒后颗粒的粒径大小,如转子速度越快,筛网孔径越小,整粒后颗粒粒径越小。
根据工艺需要,首次整粒后的颗粒可进行二次或多次整粒,如将首次过筛整粒的颗粒通过筛分设备进行筛分,将筛分后得到的大颗粒再次粉碎过筛。整粒设备与干燥设备建议密闭连接,采用垂直下料或真空上料,避免粉尘产生和扩散。整粒过程,需要控制出料速度,若速度过快,可能会出现整粒机颗粒架桥导致堵料的现象。
A. 厢式千燥
厢式干燥缺点是干燥时间长,若颗粒中有可溶性物料,可能会造成其迁移;而且在干燥过程中箱体内的温度均匀性可能较差。设计优良的干燥器通常厢体内每点的温度和设定温度之间的差值小于2~3化,为了使干燥均匀,达到干燥过程可控,通常需准确控制进风量、进风温度、湿度和干燥时间,从而尽量保证厢内的温度均匀。
另外,干燥盘内的物料层不能过厚,必要时在干燥盘上开孔,以使空气透过。
以上方面在选择厢式干燥器和验证厢式干燥器的干燥工艺时需要评估和测试。
同时应该有实验证明在干燥终点时,颗粒的含水量是均匀的。
生产过程一般如下:
a.检查准备
对用到的区域进行检查确认,包括设备设施、现场文件、温湿度、清洁消毒效期等。
b. 上料
一般采用人工将湿颗粒装入干燥盘中,每个盘中颗粒量需无太大差异,同时需要将颗粒均勾平铺在干燥盘中。
c. 干燥
按批准的工艺进行参数设置,开始干燥,同时在干燥过程中翻盘的均勾性影响最终干燥的均匀性。
此步骤关键控制点有进风量,进风温度,湿度,干燥时间,干燥盘的摆放,颗粒的厚度,待干燥颗粒的量,干燥过程中是否需要翻盘和翻盘的次数应经过验证,并在实际操作中严格遵守。干燥温度需监控,最好能实时记录,并设有超限时报警功能。
d. 卸料
将干燥盘中的颗粒收集到容器中,进行下一步过筛整粒操作,收集颗粒时,应避免粉尘扩散。
e.清场
卸料后,把颗粒转移至符合规定的条件进行暂存,最后对房间设备设施进行清理清洁。
B. 流化床干燥
a.生产前检查
对用到的区域进行检查确认,包括设备设施、现场文件、温湿度、清洁消毒效期和用到的物品器具等,比较难清洁的器具应按活性成分专用,如物料管道(必要时)、流化床过滤布袋或过滤筒等应核对专用标识。
b. 上料
湿颗粒通常是直接由制粒机转移到流化床中,通常由容器中真空吸人或靠重力进料。
c. 干燥过程和过程控制
干燥通常分为三个阶段:流化床预热阶段,此阶段先是颗粒升温,颗粒升温至饱和蒸汽的湿球温度,水分流失速度渐渐加快;然后是恒速干燥失水阶段,颗粒表面的空气接近饱和,干燥速度由气流的湿度和流速决定,在这个阶段,颗粒表面的温度停留在饱和蒸汽的湿球温度,通常是30°左右,因产品不同可能会有差异;最后是干燥速率下降阶段,此阶段水分的迁移速度较慢,不能保证颗粒表面的空气为饱和蒸汽。干燥速率取决于粉末间架桥形成的孔结构和水分的迁移机制,因此,颗粒的温度不再维持在饱和蒸汽的湿球温度,开始接近进风温度。
颗粒干燥的速率与空气的性质(如相对湿度、温度)和颗粒内部水分(如自由水和结合水)有关。如在恒速干燥阶段,颗粒中的含水量较多,其表面的水分汽化扩散到空气中,内部水分及时补充到表面,保持充分润湿的表面状态,所以恒速干燥阶段的干燥速率主要取决于水分在表面汽化的速率,主要受外部条件的影响。此时通过提高空气温度、降低空气湿度,从而提高传热和传质效率;或改善颗粒与空气接触的情况,提高空气流速使颗粒表面气膜变薄,降低传热和传质的阻力,最终提高干燥速率。
在降速干燥阶段,颗粒内部水分向表面移动已不能补充表面汽化水分,颗粒表面逐渐变干,温度上升,其速率主要由颗粒内部的水分向表面扩散的速率决定。而内部水分扩散的速率主要取决于颗粒本身结构、形状和大小等。可通过提高颗粒温度,改善颗粒分散程度,以促进内部水分向表面扩散速率,从而提高干燥速率,改变空气的状态和流速对干燥影响不大。
通常,干燥终点由干燥时间和离线样品水分检查结果相结合来确定。也可采用间接的测量方法,如干燥物料温度、出风温度和湿度推断干燥终点,因为这些参数在整个干燥过程中基本保持不变,只有在干燥速率下降时才开始变化,当这些参数出现变化时开始监测干燥物料的水分,当水分到达控制标准范围内即可停止干燥。另外,近红外技术提供了实时监测流化床中产品含水量的手段,物料的含水量在干燥过程中会发生变化,干燥过程中可以用近红外仪测量产品含水量,从而准确判断干燥终点。
为了证明于燥结束后样品水分是均匀的,一般在验证阶段需要进行确认,在颗粒的上、中、下三层和每层的不同位置取样检验。
d. 卸料
对于小型设备通常只能用手工方式卸料,如手工翻转出料。对于大型的生产设备,通常卸料方式为真空转移或直接从流化床的底部卸料和翻转卸料。一般卸料过程同步进行过筛整粒。
e.清场
生产结束后,需计算本过程的物料平衡和收率,并按规定的存储条件进行暂存,最后对房间设备设施进行清理清洁。
实例分析
湿法制粒产品工艺及生产控制举例
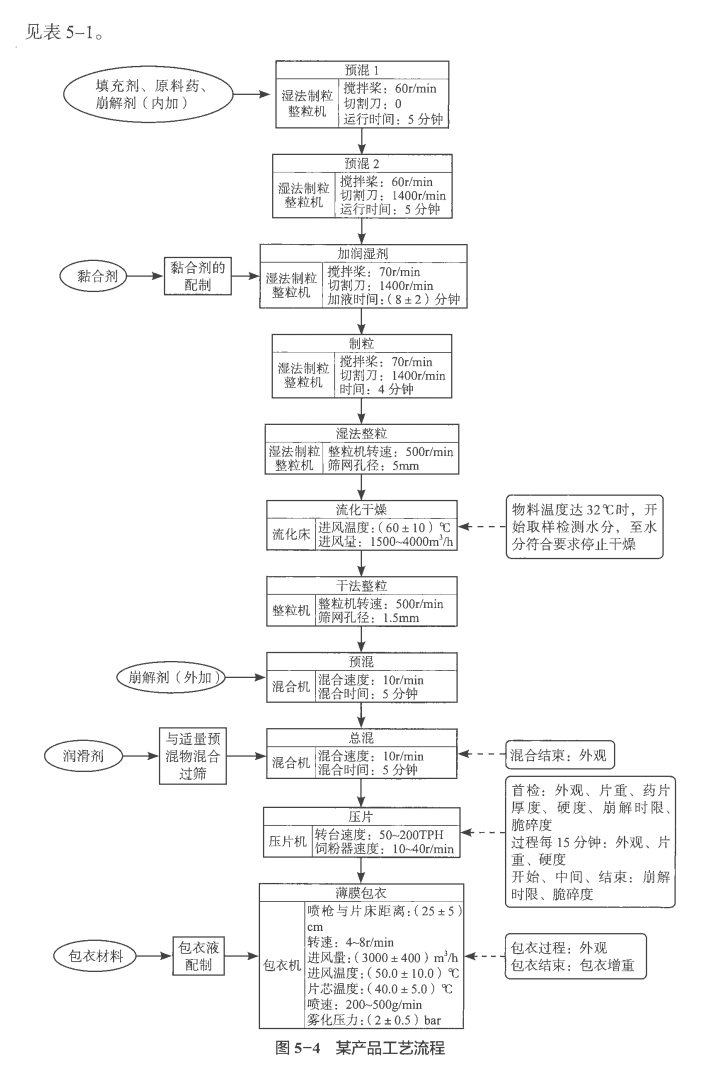
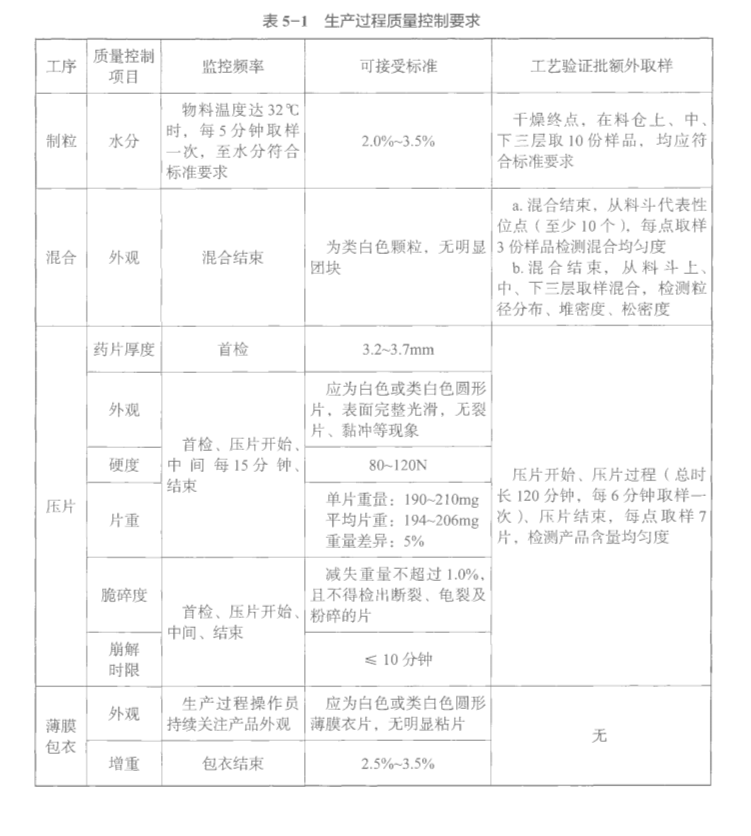
某片剂产品生产过程(湿法制粒工艺)控制举例(案例中所举例参数范围及控制标准仅作示例,不作为参考),某产品工艺流程见图5-4,生产过程质量控制要求
要点备忘
• 干燥步骤的上料及出料过程应尽量避免颗粒的暴簬,尽量采用密闭操作,房间应保持相对负压,并采用直接排风。
• 流化床过滤器、过滤布袋及连接管道(必要时)应明确标识,按活性成分专用。
• 干燥厢/流化床的进风应满足口服固体制剂生产洁净度的要求,避免对产品产生污染。
• 设备温度探头应定期校准,确保温度的准确性。
• 要关注干燥过程颗粒状态,防止颗粒局部过湿或过干。
• 干燥厢干燥盘如使用垫布应按活性成分专用。
5.1.2.3 生产过程控制
关键质量指标:日常生产中一般干燥终点应监测物料水分,整粒结束检查干颗粒外观。同时,产品的研究及验证过程应在终混后收集颗粒的粒径分布、堆密度和振实密度等数据,并结合质量风险管理,评估建立商业化生产批次针对上述项目有效控制措施的必要性。
外观:关注颗粒颜色、性状且应无异物。
水分:常用的水分测定方法有烘干法和费休法。烘干法建议使用卤素水分测定仪:采用卤素灯热解重量原理,通过加热系统快速加热样品,使样品的水分能够短时间内完全蒸发,从而能够在很短时间内检测出样品的含水率。针对熔点低的物料建议使用费休法,该法是根据碘( 碘)和二氧化硫在吡啶和甲醇溶液中与水定量反应的原理来测定水分,具体的检测方法详见《中国药典》通则 0832。
碘)和二氧化硫在吡啶和甲醇溶液中与水定量反应的原理来测定水分,具体的检测方法详见《中国药典》通则 0832。
粒径分布:常用分析方法为机械筛分法,具体的检测方法详见《中国药典》通则0982。
堆密度和振实密度:粉末在松散状态下的填充密度为堆密度,粉末在振实状态下的填充密度为振实密度,通过比较堆密度和振实密度的差异,计算粉末的压缩性指数或豪斯纳比率,可有效评估粉末的可压缩性,具体的测定及计算方法详见《中国药典》通则 0993。
5.1.3 混合
背景介绍
混合是将原料和辅料,或不同亚批颗粒之间混匀的过程,目的是保证产品的含量均匀性。典型情况下,制药行业使用的混合机在不连续的情况下按批次生产。根据混合机的不同,物料的混合按照剪切混合、对流混合和扩散混合三种方式进行。
技术要求
对于混合工艺来说最关键的一点是如何能够达到其混合均匀度的要求,无论是对于制粒前混合、制粒后混合还是粉末直混,混合不均匀可能会导致产品不能符合规定的质量标准。
物料粉体性质(如粒度分布、表面特点、堆密度、含水量、流动性、黏附性等),以及各个组分的比例均会对混合效果产生影响。
设备类型,如容器的尺寸、挡板的设计、表面的粗糙度以及旋转的角度,也会对混合效果产生影响。
操作条件,如转速、装料体积、装料方式、混合时间均会直接影响混合的效果,应当选择适当的填充体积、转速和适当的防静电措施以防结块,确保混合均匀。
A. 生产过程
a. 检查准备
检查确认房间温湿度符合要求,房间设施清洁消毒在效期内,无与本批无关的文件、物料、产品等。
空机运行,检查并确认混合机功能正常。
领取物料并核对确认物料信息的正确性。
领取混合用的器具、物品,如混合料斗、筛网等,检查并确认其已洁净。
b. 上料
根据注册工艺要求,按规定的顺序逐个加人所需要的物料。
c.混合
混合工艺相对比较简单,主要目的是使混合后物料含量是均匀的,且通过加人助流剂、润滑剂等进行混合,以满足后续工序的使用要求。混合的参数一般有混合转速和混合时间等,影响均匀性的关键参数为转速和混合时间。混合料斗的选择应根据产品批量的大小及产品堆密度测算,使料斗的装载量在确认过的范围内。
混合后的物料若需要暂存,应进行验证,确认物料暂存期内的稳定性及均一性。
建议暂存在原混合容器中,若物料需从混合容器中转移出,必要时应考虑转移过程对混合均一性的影响。
d. 清场
生产结束后,需计算本过程的物料平衡和收率,并按混合物料的储存条件要求进行暂存,最后对房间设备设施进行清理清洁。
B. 生产过程控制
混合均匀度是混合工艺的关键质量指标,应对产品全生命周期中关键批次进行考察,如工艺验证、临床研究、上市后变更等批次。考察批次需结合产品特点进行评估,确保产品质量始终如一。根据研究结果并结合质量风险管理,建立商业化生产批次混合均匀度有效控制的策略。
混合均匀度的取样位置应考虑设备的结构特点,确定设备最可能存在的死角,分层进行取样,一般涵盖物料的上、中、下层及卸料区域。常见混合设备取样示意图见图5-5。
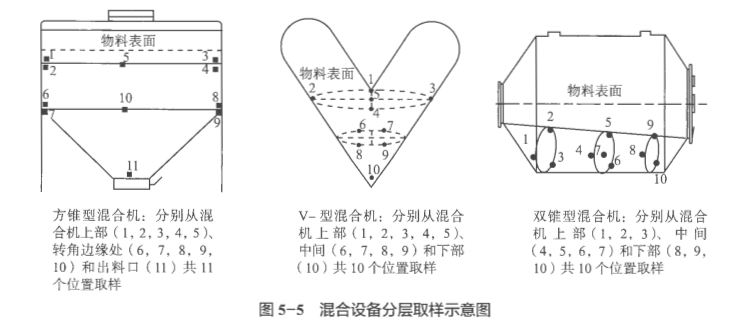
混合均匀度取样点建议至少选取10个,每点取样3份,取样量通常在单剂量的I~10倍内,如果取样量大于3倍单剂量应有科学的论证,每份样品应全量转移用于分析,避免二次分样。样品检测量及结果评价要求详见《化药口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则(试行)》。
另外,ISPE 针对混合均匀度及剂量均匀度也提出了相应的建议,介绍了在产品生命周期中不同阶段的控制策略,详见ISPE 文件:Recommendations for theAssessment of Blend and Content Uniformity: Modifications to Withdrawn FDA DraftStratified Sampling Guidance.
要点备忘
。选择合适体积的混合料斗、设置正确的混合速度与时间,并对混合机时间及转速的准确性定期进行校准。
。混合后物料应按照验证过的方式储存,并在规定的暂存期内使用。
5.1.4 压片
背景介绍
为方便药物服用,可将制得的颗粒、粉末或微丸乐制成一定形状,如圆形、椭圆形、囊形等。药片的形状由冲模决定,冲模上可增加刻字、刻痕等。增加刻字为避免混淆差错;刻痕分功能性和非功能性,如服用剂量有半片,则可在冲模上增加一个功能性刻痕。
技术要求
压片机主要由驱动系统、饲粉填充系统、压片成型系统、润滑系统和剔除系统等功能部分组成。
冲模分三部分,上冲、中模和下冲,一般上冲和下冲设计时需有刻字,目的是防止混淆差错。为了确保从每个冲模孔中产出的药品片重差异、尺寸和硬度无太大差异,冲模的加工精度要高,如下冲杆长度,直接影响中模孔中粉量的多少。
压片一般采用重力下料和真空上料将物料转移进入饲粉器内,颗粒在饲粉器内布粉进入中模孔中,上冲、下冲上下运行进入中模孔中,先上冲、下冲通过预压轮预压排粉体内空气成型,再通过主压轮压制符合预期重量和硬度的片子。双层片需压片机具备两个饲粉器,第一层药粉通过饲粉器进人中模孔压制成型,第二层药粉再进入中模孔中,通过主压轮一次压制成型,成型后的药片的硬度及每一层的药片的重量需符合要求。对于多层片产品,需压片机具备相应层数饲粉器,压片过程同双层片。
冲模高速上下移动,阳力是影响移动的关键,一般设有润滑系统,润滑系统中润滑时间和间隔显得至关重要,油量太多,容易流人产品中,润滑太少冲杆阻力太大,增加了冲杆的摩擦,润滑油应选择食品级润滑油。
A. 压片过程
a.检查准备
对用到的区域进行检查确认,包括设备设施、文件记录、温湿度、清洁消毒效期等。
领取压片用冲模等模具。冲模应专人上锁管理,领取时应核对编号的正确性,检查其外观是否完好,领出后需进行清洁。
领取压片用总混颗粒,需确认总混颗粒的名称、批号、重量及质量状态的正确性,且在规定的暂存期内。
b.上料
药粉的进料系统可能影响药片质量,低速压片机通常用人工料铲加料,需注意减少粉尘的产生及对操作者的保护;高速压片机的加料方式则包括气动传输和重力加料,颗粒再通过下料管道,进入到饲粉器中,此过程为密闭加料,可以有效避免粉尘的产生。多层片各饲粉器之间应有有效防漏粉措施。
c.压片
药片的硬度由设备压片时的压力决定,片重由中模的填粉深度决定。
制粒过程由于物料批次间的细微差异、制粒过程的微小变化等因素的影响,每批颗粒粒径分布、密度等性质略有差异,故每批产品正式压片前,需先进行试压片,调整主压力和填充深度参数,以获得满足片重和硬度要求的药片。双层片或多层片,每层均需进行试压,确保每层片重均满足要求,最终药片的硬度、脆碎度、崩解时限(必要时)等其他质量指标均符合要求。
试压片结束后进行正式压片,压片过程需要开启设备主压力剔除功能、配套使用除粉设备和金属检测设备。药片从压片机出料口出来后,进入除粉设备筛片机和金属检测设备,合格药片最终到达收集桶中。
一般压片机配备有主压力剔除系统,主压力直接影响药片硬度,目的是剔除压片过程主压力超出限度范围所压的药片,避免硬度不合格的药片混入合格药片中,故每批产品生产前需确认剔除系统功能正常。压片配套使用的金属检测机,可有效检测并防止金属异物进入产品中,每批产品生产前及生产结束需用标准金属样片(铁、非铁、不锈钢)对剔除功能进行确认,剔除样片需避免交叉污染和差错混人产品中。
压片的主要操作参数有转台速度、饲粉器速度、填充深度和主压力等。转台速度决定产出量,转台速度越快,饲粉器速度越快,才能确保药粉能及时填入到中模孔中;填充深度代表药粉填入中模孔的量,代表的是药片的重量;主压力反馈药片的硬度,药粉有一定的可压缩性,在药片的可压缩性范围肉,主压力越大硬度越大。
进行压片操作时,为保障在恒定转速、稳定的片重和压力下生产出高质量药片,根据工艺设计的不同,各种应用模式应用在高速压片系统中:
。片重控制(不带自动调节功能):了减少片重的波动,通过设立固定数值的精确定料控制台来达到要求片重。由人工来检测片重值。此时,可通过微调药片厚度来达到压力值,进一步达到硬度要求(对于稳定的配方,在大多数经验证的工艺范围内,压片机的主压力与药片的硬度成同向关系,特殊配方例外)。
• 硬度控制方式,在固定压力的设定下,通过自动微调药片厚度来达到片重的质量要求。
• 片重控制(白动调节功能):通过自动装置检测片重,回馈信号至PLC,联系上述两种方式进行自动调节压力设定,以达到乐片机所初设的片重设置。
。药片厚度通过设定的硬度值或者直接设定填料深度来控制。一些情况下,厚度控制是因为有些包装(如泡罩包装)会受片子厚度影响。
高产量的设备、自动化系统可以进行片子称量和数片。包括IBC 在内的专门收置药片的设备,其附带料口和软质的下料口阀门。
d. 清场
压片结束后,需计算本过程的物料平衡和收率并按存储条件进行暂存,最后对房间设备设施进行清理清洁。
B. 生产过程控制
压片过程的关键质量指标:常规商业化批次生产—般应控制素片的外观、平均片重与单片重量或重量差异、硬度、崩解时限(如需要)、脆碎度与药片厚度;针对产品全生命周期中关键批次:如工艺验证、临床研究、上市后变更等批次,应额外监测素片中控剂量单位均匀度,根据研究结果并结合质量风险管理,建立商业化生产批次产品含量均匀度有效控制的策略。
在压片生产过程的不同阶段上述控制指标的控制频率及取样量有所不同,具体如下。
首样:外观、平均片重与单片重量或重量差异、硬度、崩解时限(如需要)、脆碎度与药片厚度,除崩解时限和脆碎度按照《中国药典》通则取相应样品量外,其他检测项目样品检测数量应不少于压片机冲头数。
过程样:外观、平均片重与单片重量或重量差异、硬度需要高频率监测,并根据其变化趋势及时对压片机控制参数进行微调,以保证片重与硬度在内控的标准范围内。崩解时限、脆碎度需要监测,但检测频率可适当降低。检测样品量一般少于首样,建议结合压片机性能合理制定。
控制标准如下:
外观:重点关注异物点、黏冲、裂片或掉盖等情况。
平均片重与单片重量或重量差异:《中国药典》通则0101 规定,平均片重或标示片重在0.30g以下的,重量差异应不超过 ±7.5%,否则,重量差异应不超过 ±5%;另外,片剂成品的含量与素片片重直接相关;为了确保成品重量差异与成品含量符合标准要求,压片过程中需对素片的平均片重及单片重量制定更严格的控制标准,例如:成品含量可接受标准为95%~105%,素片平均片重为200mg,则素片平均片重可控制在97%~103%(194~206mg),每一单片的重量在95%~105%(190~210mg),当单粒重量出现偏大或偏小值时,应进一步确认装量差异能否满足要求,重量差异不超过 ±5%。
硬度:根据工艺要求给定控制标准。
崩解时限:《中国药典》通则 0921 对不同剂型片剂崩解时限的检测条件及控制标准要求不同,素片的崩解时限控制标准可结合剂型特点、药典标准以及产品的工艺控制要求来制定。
脆碎度:减失重量不得过1%,且不得检出断裂、龟裂及粉碎的片,具体的测试方法及要求见《中国药典》通则 0923。
药片厚度:根据产品,工艺要求给定控制标准。
剂量单位均匀度:压片工序剂量单位均匀度取样一般不少于20个时间点,应涵盖压片开始、结束、中间停机再开启的过程,储料罐和中间体容器的加料过程等,每个时间点取样至少7片,若有特殊情况,如批量小、压片时长较短等,无法满足上述取样量的要求,应有科学的说明。样品检测量及数据评价要求详见《化药口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则(试行)》。
另外,ISPE 针对混合均匀度及剂量均匀度也提出了相应的建议,介绍了在产品生命周期中不同阶段的控制策略,详见ISPE文件:Recommendations for theAssessment of Blend and Content Uniformity: Modifications to Withdrawn FDA DraftStratified Sampling Guidance.
要点备忘
。装机前应确认领取冲模的正确性与完好性。
。压片设备应配备局部除尘设施,避免粉尘扩散带来的污染。
• 应检查在线剔除功能/ 设备(如主压力超限剔除功能、金属检测功能等)是否正常,确保异常产品被正确剔除。
•压片过程中间控制样品应按规定抽取并及时检测,有不良趋势应及时反馈到岗位操作员,对压片参数进行调整;检测结果有异常,应对相应产品做好隔离并调查。
5.1.5 包衣
背景介绍
包衣一般是指在片剂(常称其为片芯或素片)、微丸或颗粒的外表面包裹上一定厚度的衣膜。包衣技术在制药工业中越来越占有重要的地位,包衣设备和包衣材料的发展使得包衣应用越来越广泛。包衣既有功能性目的,也有非功能性目的,主要包括以下内容:
•保护药物不受光照、吸潮的影响,增加药物稳定性。
•改善制剂的外观质量。
•掩盖苦味或不良气味,增加患者的顺应性。
•防止药物的配伍禁忌。
•改变药物的释放部位及速度,如胃溶型、肠溶型、缓(控)释等。
包衣的种类主要有两大类,即糖衣和薄膜衣,其中薄膜衣一般又分为胃溶型、肠溶型和缓释型三种。
技术要求
包衣常用设备有包衣锅和流化床,其中包衣锅通常被用于药片包衣,流化床通常被用于微丸或颗粒包衣。包衣锅组成和流化床组成类似,由锅体、进风系统、排风系统和喷液系统组成。
包衣即在底物上包一定厚度的衣膜,包衣过程,是一个喷液和干燥的湿热平衡状态,即包衣液喷出后附着在底物上,包衣液中成膜材料进行延展,延展过程及时干燥。包衣锅内产品温度或排风温度显得至关重要。
流化床包衣设备主要组成同流化床制粒设备。微丸包衣产品多缓(控)释产品,如肠溶、缓释等。流化床包衣产品由于底物小,包衣技术较复杂,工艺难度较大,喷液速度、雾化压力、进风量、进风温度、进风湿度等均可能影响包衣效果及药物释放速度。包衣过程衣膜过湿或过干均可能会增加粘丸的风险,如喷液越快,膜致密性越好,但也可能会过湿,导致粘丸;进风温度高,影响成膜,静电现象明显,也会造成粘丸。
A. 包衣材料
薄膜包衣材料主要由高分子聚合物、增塑剂、抗黏剂、色料/遮光剂、速度调节剂和溶剂组成。
a. 高分子聚合物
常用的高分子聚合物有纤维素衍生物和丙烯酸树脂类,其中纤维素衍生物包括酯类、醚类、醚酯类。按薄膜衣层的作用主要分为3类:
• 普通薄膜衣材料:主要用于改善产品外观,改善吸潮和防止粉尘等的包衣材料,如羟丙基甲基纤维素、甲基纤维素、羟丙基纤维素、聚维酮等。
• 肠溶包衣材料:常用的肠溶性包衣材料有醋酸纤维素酞酸酯(CAP)、甲基丙烯酸共聚物、聚醋酸乙烯酞酸酯(PVAP)、羟丙基甲基纤维素酞酸酯(HPMCP)。
b.增塑剂
c. 抗黏剂
( 滑石粉)等固体物料能防止颗粒或片剂在包衣过程中粘连。
滑石粉)等固体物料能防止颗粒或片剂在包衣过程中粘连。
d. 色料/遮光剂
色料/遮光剂主要分为有机色料及其色淀,如日落黄、柠檬黄、赤藓红;无机色料,如二氧化钛、黄色氧化铁、红色氧化铁等,无机色料的重要特征是对光稳定,具有遮光能力;天然色素,如核黄素、胭脂红等。色料/遮光剂的选择同时要考虑各国法规允许使用的情况,如二氧化钛欧盟不建议使用(见 EMA 指南 Final Feedbackfrom EMA to EU Commission Request to Evaluate the Impact of the Removal of TitaniumDioxide from the List of Authourized Food Additives on Medicinal Products),色素酒石黄在美国是不建议使用的,如有使用需在药品说明书中增加相关说明(见21CFR201.20),赤藓红已从 CFR(美国联邦法规)安全使用清单中删除。
很明显,此类物质能够达到产品美观的要求,且在改善产品性能方面也能起到以下作用:
• 遮光性,二氧化钛等无机色料对光稳定,对于含有避光活性物质的产品是必要的。
• 使药厂的标识形象更突出,便于鉴别,防止假冒。
e.速度调节剂
释放速度调节剂又称溶出促进剂或致孔剂、致流剂,其中较常用的辅料为水溶性的辅料,如蔗糖、聚乙二醇和表面活性剂。含这类调节剂的薄膜衣,一旦遇到水性液体的作用,水溶性调节剂迅速溶解,留下一个多孔膜作为扩散屏障。
f.溶剂/介质
一般来说,聚合物要分散或溶解在适当的溶剂中,再包于固体制剂上。溶剂主要分水性溶剂和有机溶剂。选择溶剂的先决条件是它必须与所选择的聚合物相互作用良好,能使薄膜的黏着性、机械强度得到改善。过去水不溶性高分子材料基本都用有机溶剂溶解后再用于包衣操作,目前采用聚合物的水分散体系得到了广泛的应用。同一成膜材料,使用不同的溶剂配制,成膜性能可能不同,进而导致药物溶出行为的不同。
B.薄膜包衣过程
包衣常用设备有包衣锅和流化床,此处采用包衣锅对药片包衣为例,说明薄膜包衣过程。
a. 检查准备
对用到的区域进行检查确认,包括设备设施、文件记录、温湿度、清洁消毒效期。
领取洁净的搅拌罐、喷枪、管道等,搅拌罐的大小应与包衣液量相匹配。
空机运行包衣机,确认设备功能正常,如可正常升温、降温等。
凭记录领取包衣材料和药片,领取时需双人确认领取的重量和记录标识上重量是否一致,同时名称、批号等信息是否正确,药片是否在规定的暂存期内。
b. 包衣溶液或混悬液的配制
薄膜包衣溶液或混悬液通常在包衣操作间进行配制,根据工艺规程或批记录中的批处方量,将适量的溶剂加入带搅拌的容器,并按工艺规定的顺序加入其他包衣物料,以一定的速度搅拌,使液面形成漩涡,带动整个容器的液体,直至混合均匀。
混合容器搅拌桨的高度、桨叶的大小要适宜,能够使物料充分混匀。对于混悬液,在包衣过程中,为了保证混悬液的均匀性,搅拌桨应持续搅拌,直至包衣结束。
需关注混悬的包衣液中有无团块,可在包衣液搅拌分散后进行过筛,避免包衣过程喷枪堵塞,影响包衣液喷射角度和雾化状态。
配制包衣液用的纯化水,需现配现取,同时配制好的包衣液需要做暂存期研究,确保包衣液在规定的暂存期内使用。
c.装料
将待包衣的片芯装载到包衣锅,通常手动装料,把片芯从容器中经装料口直接转移到包衣锅中,也可以用气动输送的方式将片芯装载到锅内。
d. 预热
片芯被装载到包衣锅中,在比较慢转动速度下或间歇性转动,热空气吹片床进行预热,至出风温度达到要求,便可以开始喷液。预热结束应取样监测素片片重,用于后续包衣增重的计算。
e.喷包衣液
在喷液过程,包衣锅持续转动,使片子不断翻动,同时进风也持续吹进锅内,热量由空气传入到药片中,进而将液体转化成蒸汽,蒸汽随热空气排出。滚筒的转动速度是一个关键控制参数,转速设定过快,会导致片芯磨损,而降低转速,虽然降低片芯磨损风险,但也延长了药片通过喷射区的时间,降低干燥效率,增加了片面过湿、衣层不均匀的可能性。
喷雾过程包括雾滴的产生,雾滴从喷枪向片床的移动,雾滴在片芯表面上的润湿、撞击、铺展以及蒸发成膜。喷系统应满足以下要求:
• 能够产生小粒径分布的雾滴。
• 能够处理固体含量在8%~20%、有一定黏度的混悬液。
• 构造简单,易于清洁。
• 喷射角度能够控制和调整。
喷雾的操作条件对薄膜包衣的成败至关重要,在包衣过程中,要求雾滴在到达片芯表面后均匀散布,并形成一定厚度的均匀薄膜。当雾滴从喷枪喷往片床表面时就开始干燥,打到片面时呈部分干燥状态,沉积到片面后液体变得更浓,同时残留液体被快速蒸发掉可避免片芯将其吸收。过程主要工艺参数如下:
。锅的转动速度
。 喷枪到片床的距离
•喷射的角度和方向
◎进风量
。进风温度
• 进风湿度
。喷液速度
• 雾化压力/扇面压力
• 出风口温度/片床温度
在气压雾化过程中,包衣液以一定的速率被输送到喷枪,并在相对较低的雾化压力下形成雾滴,喷雾速率和雾化压力的设定要与雾滴的蒸发效率相适应。通常,使用多通道的蠕动泵输送包衣液,一个通道供应一个喷枪。雾化压力是影响雾滴粒径大小的关键参数。喷枪到片床的距离、扇面压力、喷射的角度和方向也是影响喷雾效果的重要控制参数。
在这些变量中,任何一个变量的作用都会受到其他的一个或多个变量的影响,因此,这些因素通常都不是单独起作用的,这些因素综合影响包衣环境的湿热平衡。
例如避免片子粘连,可以选择减小喷速,提高进风温度或进风量,调整喷射角度和雾化压力。关键的工艺参数为片床温度或出风温度,包衣过程中通过调整上述控制参数以使片床温度或出风温度达到工艺控制的要求。
在包衣过程中,排出的空气会含有一定量的从亚微米到 200~300um 的粉尘微粒。
这些微粒来自于片剂粉尘或被干燥的包衣物料。为了防止环境污染,这些粉尘必须被除去,常用的粉尘除去装置包括旋风分离器、织物滤袋、粉尘收集器和湿洗涤器。
f. 干燥和冷却
喷雾结束后,可以在包衣锅内继续干燥一段时间,然后降温,再进行卸料操作。
g.卸料
包衣结束后,包衣片的卸载有多种不同的操作方式,具体如下:
• 操作工用料铲手工卸料,料铲边缘应为弧形,不能造成包衣片损坏。
。通过包衣锅底部阀门,利用重力卸料。
• 正向转动包衣锅,利用一个特制的卸料铲斗使包衣片提起,并通过包衣锅门安装的滑道卸到包衣锅前的容器中。
•反向转动包衣锅的卸料方式,利用包衣锅中固定的挡板,在包衣锅反向转动时,片子被提起,并通过包衣锅前的密闭滑道卸到容器中。反向转动卸料是唯一的一种可以不用打开包衣锅门的卸料技术。
h.清场
包衣结束后,需计算本过程的物料平衡和收率并按存储条件进行暂存,最后对房间设备设施进行清理清洁。
C. 生产过程控制
片剂的包衣过程关键质量指标有:外观、增重、崩解时限(如需要)。
外观:重点关注产品刻字是否清晰、是否有色差与花斑、包衣片是否完整、片面是否光滑等,包衣过程需频繁对包衣产品外观进行监控,及时对包衣参数进行微调。
包衣增重:一般包衣结束,取样薄膜衣片计算包衣增重,包衣增重=(薄膜衣片平均片重-素片平均片重)/素片平均片重,包衣增重的控制标准根据工艺要求制定。
崩解时限:崩解时限的控制标准应结合剂型、工艺及《中国药典》的要求设定,详细的检测方法及标准要求可参考《中国药典》通则 0921。
D. 缓(控)释包衣及肠溶包衣
片剂缓(控)释包衣及肠溶包衣和普通薄膜包衣过程完全一样,只是包衣的材料有差别,缓(控)释包衣材料为功能性,普通薄膜包衣为非功能性。
用不同性质的包衣材料包出的药片或小丸,可以使药物达到特定的释放速率,也可以使药物在体内特定的部位释放,如胃部或肠部,该过程称为调节药物释放的包衣。肠溶衣是缓(控)释包衣的一种类型。肠溶衣膜可以阻止药物在胃部释放,防止药物刺激胃黏膜,或避免药物被胃酸或胃内酶类破坏。
缓(控)释包衣和普通薄膜包衣的操作基本一致,区别是要进行不同性质衣膜层的包衣操作,以达到控制药物释放的目的,参数设置变化相对复杂。
在进行缓(控)释包衣生产过程中,片芯或基丸质量的均一性对包衣的效果有很大影响。包括外观平整度、基丸的形状和大小会显著影响衣层的覆盖效果,进而影响产品的释放速度。此外,如果包衣过程的控制不好,包衣物料分散不均匀,片芯过湿,或者在到片床前雾滴已经被干燥也会降低药物包衣的作用。
E.包糖衣
虽然薄膜包衣技术发展迅速,但药物包糖衣工艺仍被应用。与薄膜包衣不同,包糖衣是多工序过程,且相当依赖于操作者的经验和技艺。
糖浆的制备:糖浆熬制材料为蔗糖和纯化水,按照处方配比把纯化水加人蒸汽锅中,加热至沸,慢慢加人处方量的蔗糖,边加边搅拌,保持合适的蒸汽压维持微沸状态,至蔗糖溶解,把表面的泡沫撇去,用糖度计确认糖浆浓度符合要求,停止加热,趁热过100 目筛,筛至糖浆贮存容器中保温备用。若要增加糖浆的黏度,可加入明胶或阿拉伯胶等;若要加入食用色素,应将色素溶解,逐次加入糖浆中,使颜色由浅至深。包衣过程中糖浆应持续搅拌混合并保温。
包糖衣主要分为以下6个步骤:
a.包隔离层
包隔离层是为了形成一层不透水的屏障,防止糖浆中的水分浸人片芯。可供选择的材料有:10%的玉米朊乙醇( 乙醇)溶液、醋酸纤维素酞酸酯乙醇溶液等。因为包隔离层使用的是有机溶剂,所以应注意防爆、防火,采用中等干燥的温度(40~50°C)。
乙醇)溶液、醋酸纤维素酞酸酯乙醇溶液等。因为包隔离层使用的是有机溶剂,所以应注意防爆、防火,采用中等干燥的温度(40~50°C)。
b.包粉衣层
糖衣片的理想形状是边缘很薄的双面凸型片,为了尽快消除片剂的棱角,多采用交替加人糖浆和滑石粉的办法,在隔离层的外面包上一层较厚的粉衣层,使片芯具有圆整的外观。片重的增加主要发生在粉衣层。为了增加糖浆的黏度,也可以加人一定量的明胶或阿拉伯胶。
c.包糖衣层
粉衣层的片子表面比较粗糙、疏松,因而再包糖衣层使其表面光滑平整坚实,一般用较稀的糖浆,包至10~15 层即可得到下步工艺所需的片子。
d. 包有色糖衣层
包有色糖衣层和上述包糖衣层工序相同,目的是为了片剂的美观和便于识别,区别是在糖浆中加入了色料,包有色糖衣层要注意着色的均匀性,避免产生花斑。
色料包括食用色素、色淀、氧化铁粉等,并加入二氧化钛粉作遮光剂。
e. 打光
目的是为了增加片剂的光泽和疏水性。打光前片子的干燥是非常重要的。打光剂一般有虫白蜡、川蜡、巴西棕榈蜡等,通常也会加人适量的硅油以增加片子的光亮度,降低糖衣片在存储期内变色、霉变的风险。
f. 印记
印字的目的是便于标识,提高药物的识别度。与薄膜衣片不同,包糖衣片不宜在片芯表面由压片机直接压字,只好在其表面印字。一般可用食用级的油墨。
F.微丸包衣
微丸包衣以药用微丸丸芯为底物进行包衣,常用的药用微丸丸芯有蔗糖型、微晶纤维素型和淀粉型。
微丸包衣采用流化床包衣技术,主要有三种工艺:底喷、切线喷、顶喷。由于设备构造不同,物料流化状态也不相同;采用不同工艺,包衣质量和制剂释放特性可能有所差异。其中,底喷工艺(又称为 Wurster 系统)在微丸包衣中应用最普遍。
流化床包衣是在充分了解底物和包衣处方性质的基础上,调节包衣过程干燥效率和喷液速率之间的平衡,以达到一个最适合包衣成膜的物料温度,物料温度通常被定义为微丸包衣过程的关键工艺参数。
喷液速率取决于3个限速因素:干燥效率、喷枪雾化能力、包衣液黏性,在流化床包衣系统中,干燥效率和喷枪化能力的可调性是很大的,很多情况下喷液速率的限速因素是包衣液黏性或包衣材料的成膜温度。如有些处方在包衣过程中只能采用较低喷液速率,出风相对湿度很低,但物料已接近于黏结,因此处方需要加人比较多抗黏剂才能达到包衣要求,否则工艺周期太长,而且生产放大过程中由于料床高度增加,黏结问题会变得更加突出。
包衣液通过压缩空气雾化成细小的液滴,雾化压力和气体量决定液滴的大小,液滴越细,形成的衣膜越致密,理想的液滴大小在5~20um。实际应用中,包衣液滴的大小应根据颗粒粒径来选择。粒径较大的颗粒包衣时不需要雾化得太细的液滴,但对于小颗粒(250um或更小),需要较高的雾化压力使形成较小液滴,以避免颗粒产生粘连现象,通常认为液滴大小应为颗粒粒径的1/50左右。雾化液滴大小还与喷液速率有关,相同雾化压力下,液滴的大小会随着喷液速率提高而有所变大。因此,包衣过程中在提高喷液速率时,如果希望保持相同的液滴大小,那么同时也需要相应地提高雾化压力。液滴大小也由包衣液性质(如黏度和表面张力)决定,不同包衣材料或处方在相同的雾化条件下,形成的液滴大小都不相同。鉴于这个原因,液滴大小通常根据经验来选择,而不是通过纯粹的数学概念来决定。
流化床干燥效率包括3个因素:进风风量、进风温度、进风相对湿度。提高进风风量和进风温度有利于提高干燥效率,但风量过大也可能降低包衣物料的成膜性,导致产生的细粉量增加。进风湿度的控制往往容易被忽略,季节性湿度变化可能造成干燥效率的明显变化。湿度过大降低干燥效率,如保持相同的喷液效率可能造成颗粒黏结,湿度过低则可能产生静电问题。而且湿度的波动也可能影响最终产品的水分残留量,进而影响产品稳定性。对于有机溶液包衣,通常选择较低的进风温度,加上有机溶剂蒸发会降低底物周围的局部空气温度,当降至低于露点温度时,有可能导致在底物表面形成冷凝水,使衣膜的连续性受到破坏。因此应通过除湿尽量保持进风的湿度一致,但不要求去除所有湿度,一定量的湿度有利于消除包衣过程的静电问题,进风过于干燥时可能还需要进行加湿。
除包衣处方和工艺外,底物的性质也会显著影响包衣质量,控制批间物料性质(如粒径、密度、脆碎度等)的稳定,是保证包衣重现性的重要前提,
要点备忘
• 包衣前领取中间产品或物料,应核对信息正确性,并在规定的存储效期内。
• 包衣液的配制应按规定的顺序加入包衣物料,且配制好的包衣液应在规定的暂存期内使用,在混悬液包衣过程中要持续搅拌以保持混悬状态。
• 配制包衣液的介质为有机溶剂时,应配备相应的安全防爆设施及环保设施。
• 包衣过程需要高频率关注衣膜外观(微丸包衣需关注微丸是否粘连),在已验证的控制参数范围内适时调整,避免过干或过湿引起产品外观的异常。
5.1.6 药片外观检查
背景介绍
产品压片和包衣过程可能会造成少量药片的机械损伤及外观异常,如黏冲、色差、衣膜破损、磕角等,一般会在产品包衣后对药片的外观进行检查。
外观检查有两种方式:人工目视检查、设备检查。设备检查使用外观检查机,检片效率高且更可靠。
技术要求
外观检查机主要通过成像检查,将采集到的药片外观图像信息与合格药片的外观图像信息进行比对,比对结果不相似,视为外观不合格,并自动剔除。外观检查机一般具备多个2D 相机和3D相机,其工作过程如下:
首先,对设备检片参数进行确认,将已知外观合格产品和不合格产品通过设备的检测通道,设置检片参数,确认外观不合格产品全部被剔除,合格产品全部进入合格通道。
然后,将需检查外观的产品通过下料装置排列好,进入检查部位,检查部位设有2D及3D的高像素彩色摄像装置,多视角对产品外观进行检查,检查部位形成的图像信息与设定的可接受图像信息比较,对比结果不相似的产品会在区分部位被剔除出来,合格的产品进入合格品收集桶。
A. 生产过程
a. 设备检片
• 检查准备:对用到的区域进行检查确认,包括设备设施、文件记录、温湿度、清洁消毒效期和其他必需的物品等。
• 上料:上料一般采用重力下料或真空上料方式,尽可能使用密闭操作,避免粉尘的产生。
• 检片:药片通过下料装置,逐个排列进入检查部位,在轨道上高速通过照相检查,不合格药片被剔除,外观合格药片进入合格品收集桶中。相机对药片的识别效果决定了检片的效果。检片过程中需注意:不能对药片外观有不良影响且能保证药片传送顺畅;为了确保剔除的准确性,需要定期对剔除功能进行确认;药片的检片,尤其素片,应尽可能缩短产品暴露时间,以降低环境对药片的影响。
• 清场:外观检查结束后,需计算本过程的物料平衡和收率并按存储条件进行暂存,最后对房间设备设施进行清理清洁。
b. 人工检片
通过肉眼对产品外观进行检查,检查过程应注意以下内容:
• 检片操作区域照度不低于3001x,必要时可增加光源,检片人员矫正视力建议不低于4.9,且检片过程需定时休息。
• 注意做好人员的防护,如佩戴口罩、眼罩、手套,避免对产品造成污染。
• 应制备标样或标样图册,指导操作人员挑出外观异常产品。
• 应尽可能缩短产品暴鎔时间,以降低环境对药片的影响。
B. 生产过程控制
设备检出外观合格的药片,过程需定期进行人工复核确认。
自要点备忘
• 应定期检查检片机剔除功能是否正常,确保外观不符合要求产品能被有效剔除。
• 若为人工检片,应定期确认检片人员的视力,检片过程中应规定连续工作最长时间及中间休息时间,避免操作员视觉疲劳。
• 关注产品的特性(如对湿度、光照敏感),控制产品的裸露时间,避免暴露时间过长影响产品质量。
5.1.7 胶囊剂制备
背景介绍
胶囊剂系指原料药物或与适宜辅料充填于空心胶囊或密封于软质囊材中制成的固体制剂,可分为硬胶囊(通称为胶囊)和软胶囊,根据释放特性的不同还可以分为缓释胶囊、控释胶囊和肠溶胶囊等。硬胶囊和软胶囊生产工艺及控制完全不同:
将原料药物或加适宜辅料制成的均匀粉末、颗粒、小片、小丸、半固体或液体等,充填于空心胶囊中制得硬胶囊;将一定量的液体原料药物直接密封,或将固体原料药物溶解或分散在适宜的辅料中制备成溶液、混悬液、乳状液或半固体,密封于软质囊材中制得软胶囊。
5.1.7.1 硬胶囊
技术要求
硬胶囊储存区域对温湿度有较严格的要求,一般建议存储温度为15~25°C,湿度为35%~65%。硬胶囊剂易受温度和湿度的影响,高湿度(>65% 相对湿度,室温)易使包装不良的胶囊剂变软,发黏,膨胀,并容易滋长微生物。若超过室温,相对湿度大于65%时,会产生更快更明显的影响,直至发生溶化。因水分会使胶囊壳本身原有的结构变化,若长期贮藏于高湿度中,崩解时间明显延长,溶出速度也有较大的变化。
硬胶囊填充机由驱动系统、真空系统、填充系统等功能部分组成。硬胶囊填充关键控制点为装量。填充类型一般包括压缩填充、真空吸料填充。
压缩填充分为填塞式和插管式两种方式。填塞式一般采用计量盘式填充,计量盘的厚度直接影响装量,填充过程,填充杆多次插人计量盘中,将粉末压成柱状,填充杆最后一次插入时将柱状粉末推至胶囊囊体中。插管式采用计量管式填充,计量管有一定的容积,填充过程,计量管插人粉末中,粉末进入计量管中被压缩,再将计量管中的粉末推出至胶囊囊体中。压缩填充需要粉末具有一定可压缩性和流动性,才能确保填充过程装量稳定。
真空吸料填充,一般用于微丸、微片、微囊等有一定形状的内容物填充。填充过程,通过真空将固态药物吸人计量管中,再断开真空,药物进人胶囊囊体中。真空压力影响装量,压力太小,在转动过程计量管中的药物容易被甩出,造成装量偏小,压力太大,会吸住多余的药物,可能造成装量偏多。
A. 硬胶囊填充类型
a. 粉末/ 颗粒填充
粉末/颗粒特征与胶囊填充过程中的产品质量有特定关联,粉末/颗粒胶囊灌装工艺需关注的粉末/ 颗粒特性包括但不限于:
•流动性
•松密度和振实密度
• 粒子大小和粒度分布
• 粒子形状
• 内部颗粒黏着力
• 水分
b. 小丸填充
通常状况下填充在硬囊壳中的为小丸或球状体。一般采用真空将微丸吸人填充管中,断开真空,微丸落人胶囊囊体中。
c.片剂填充成硬胶囊
可将微片或小型胶囊填充到硬胶囊中。受限于胶囊的直径对于内容物的尺寸有一定的限制,一般需要小于装填的胶囊内径。采用真空将微片/小型胶囊吸入填充管中,断开真空,微片/ 小型胶囊落人胶囊囊体中。
d. 多组分灌装
很多装囊机可填充一种或多种组分到胶囊中。每个组分需要有独立的灌装站。
B. 硬胶囊填充过程
a. 检查准备
对用到的区域进行检查确认,包括设备设施完好,现场无和本批无关文件,温湿度符合要求,区域、设备设施及容器具在清洁消毒效期内。
领取硬胶囊填充用物料,需确认物料的名称、批号、重量及质量状态正确,且在规定的暂存期内。
b. 上料
上料一般采用重力下料或真空上料方式,尽可能使用密闭操作,避免粉尘的产生。
c.填充
同型号不同供应商的胶囊壳,在尺寸上可能略有差异,可能会导致下囊不畅,分囊率低等问题。更换胶囊壳供应商前,需测试胶囊壳上机率。
硬胶囊填充通过充填管定量药粉,为了确保每个填充管的粉量差异在可接受范围内,对填充管的精度要求较高。
硬胶囊填充关键操作参数一般有填充速度、装量刻度、真空度等。不同填充速度下,填充管会有一个离心力,在相同的装量刻度,可能填充量会有所差异。真空度一般用于将囊帽和囊体分离;对于微丸的胶囊填充,真空度也用于微丸的填充,将微丸吸附在真空管中,放人胶囊囊体,再断开真空使微丸进入囊体中。
填充前,对设备进行调试确认,确认设备各项功能正常,进行试填充,试填充过程至少需要将每个填充管填出的胶囊进行粒重或装量检测,确保每个填充管填出的胶囊均符合装量要求。
填充过程中,粉体一直处于运动过程,粉体的变化可能会导致填充量有差异,需对胶囊重量(平均重量和单粒重量)进行监控。
从胶囊填充机出来的胶囊需经过抛光、筛选和金属检测,将胶囊表面抛光,将空胶囊、囊帽、囊体分选出,把含金属异物的胶囊剔除。胶囊进入抛光段,胶囊随毛刷转动往前运动,使得胶囊外表面粉尘被除去;胶囊再进入筛选段,通过真空负压将重量过轻的残次品如空胶囊、囊帽、囊体剔除;剩下的胶囊进人金属检测机,有金属异物的胶囊被自动剔除,正常的胶囊进入产品收集桶。
由于温湿度对胶囊有一定影响,填充过程需要控制环境温湿度,同时填充过程尽量减少空胶囊壳和胶囊的暴露时间,避免长时间的暴露导致填充过程异常或产品质量受影响。
d. 清场
生产结束后,需计算本过程的物料平衡和收率并按存储条件进行暂存,最后对房间设备设施进行清理清洁。
C.生产过程控制
硬胶囊剂中间过程质量控制指标:一般商业化生产中控制胶囊外观、胶囊重量(平均重量和单粒重量)及装量差异(当单粒重量出现偏大或偏小值时,应进一步确认装量差异能否满足要求)、胶囊锁合长度(如需要)、崩解时限(如需要):针对产品全生命周期中关键批次:如工艺验证、临床研究、上市后变更等批次,应监测胶囊剂量单位均匀度,根据研究结果并结合质量风险管理,建立商业化生产批次剂量单位均匀度有效控制的策略。
外观:重点关注胶囊壳的颜色、印字、外观是杏圆整光亮、锁合牢固,不允许有破头、沙眼、梅花头、皱皮、破口、缺口、瘪头、气泡等现象。
胶囊重量(平均重量和单粒重量)及装量差异:《中国药典》通则0103胶囊剂
项下规定,平均装量或标示装量在0.30g以下的,装量差异应不超过 士10%,否则,装量差异应不超过 士7.5%(中药 士10%);另外,胶囊成品的含量与胶囊装量直接相关;故胶囊填充过程胶囊重量的控制标准应结合成品装量差异与含量的可接受标准适当收严,例如:成品含量可接受标准为95%~105%,理论装量 400mg,则胶囊填充过程平均重量可控制在理论重量的97%~103%,单粒重量控制在理论重量的95%~105%,装量差异不超过 士5%。
胶囊锁合长度:根据工艺要求给定控制标准,通常与胶囊壳厂家提供的锁合长度标准保持一致。
崩解时限:《中国药典》通则 0921 对不同的胶囊剂成品崩解时限的检测条件及控制标准要求不同,胶囊填充过程崩解时限控制标准可结合剂型特点、药典对相应成品的控制要求及工艺的要求给定。
剂量单位均匀度:取样一般不少于20个时间点,应涵盖胶囊填充开始、结束、中间停机再开启的过程,储料罐和中间体容器的加料过程等,每个时间点至少取样7粒,若有特殊情况,如批量小、填充时长较短等,无法满足上述取样量的要求,应有科学的说明。样品检测量及数据评价要求详见《化药口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则(试行)》。
另外,ISPE 针对混合均匀度及剂量均匀度也提出了相应的建议,介绍了在产品生命周期中不同阶段的控制策略,详见ISPE文件:Recommendations for theAssessment of Blend and Content Uniformity: Modifications to Withdrawn FDA DraftStratified Sampling Guidance.
要点备忘
•装机前应确认领取的配件特别是计量盘、填充管等的正确性和完好性。
•填充过程注意对环境温湿度的控制,避免温湿度过高,胶囊暴簬时间过长,导致胶囊剂变软,发黏,膨胀,微生物滋长等。
•胶囊填充设备应配备局部除尘设施,避免填充过程粉尘扩散。
• 应检查在线剔除功能/设备(如筛选、金属检测机等)是否正常,确保异常产品被正确剔除。
。填充过程中间控制样品应按规定抽取并及时检测,有不良趋势应及时反馈到岗位操作员,对参数进行调整;检测结果有异常,应对相应产品做好隔离并调查。
5.1.7.2 软胶囊
技术要求
软胶囊剂生产工艺过程包括溶胶、压丸、干燥、拣丸、洗丸、印字等步骤。
而干明胶与增塑剂的重量决定囊壳的硬度。
软胶囊中填充的液体内容物通常有以下三类:
• 与水不相混溶的挥发性或不挥发性的液体,如植物油或芳香油。
• 能与水混溶的不挥发性的液体如聚乙二醇和非离子性表面活性剂。
• 能与水相溶而挥发性小的化合物如甘油、丙二醇和异丙醇。
如果药物是亲水性的,往往会引起胶囊壳中水分发生改变,因此内容物应保持适量的水分。药液中含水分超过50% 或含低分子量与水互相混溶的挥发性溶剂如乙醇、丙酮、胺、酸及酯类等,均能使软胶囊软化或溶解,因此不宜制成软胶囊剂。
药物若是固态,首先将其粉碎过100~200 目筛,再与油混合,经胶体磨研匀,或用低速搅拌加玻璃砂研匀,使药物以极细腻的质点形式均匀的悬浮于油中。
软胶囊的制法有两种:滴制法和压制法,压制法又分平模压制和滚模压制。压制过程中混悬的药液需要持续搅拌,以确保剂量单位均匀度;胶液需要保持在合适的温度以保持均质状态。
软胶囊干燥过快反而欲速而不达,严重的会造成外观质量不合格和崩解度变差,因此应在预干一定时间后采用自然风干。
拣丸过程中应严格控制胶囊出料速度,避免由于惯性导致不合格胶囊进入合格区域或合格胶囊进入不合格区域。
洗丸的目的是将胶囊表层的油脂去除,关键点是选择合适的溶剂,既要达到清洗的目的,又要确保不因为过多的残留而影响产品质量。
印字是在软胶囊囊皮上以适当的方式印上文字或图案,常用的方法有:字模印字法、喷墨印字法、激光刻字法。印字用油墨应为药用级别或食用级别,印字过程中要随时抽查胶囊的印字质量,确保胶囊印字清晰、完整。
A. 溶胶
将增塑剂、纯化水及附加剂按照规定的比例和顺序,加入密闭容器中,加热搅拌混合,升温至规定的温度后加人明胶颗粒,继续搅拌至明胶全部溶化为胶液,开启真空泵至规定的真空度进行脱泡,直至制得均质胶液,必要时,过100目筛网后使用。制好的胶液应保温、静置存放,并在规定时间内使用。
B. 压丸
a.滴制法
将药液加入料斗中;明胶浆加人胶浆斗中,并保持一定温度;盛软胶囊器中放人冷却液(必须安全无害,和明胶不相混溶,一般为液体石蜡( 石蜡)、植物油、硅油等)。
石蜡)、植物油、硅油等)。
根据每一胶丸内含药量多少,调节好出料口和出胶口,胶浆、药液先后以不同的速度从同心管出口滴出,明胶在外层,药液从中心管滴出,明胶浆先滴到液体石蜡上面并展开,药液立即滴在刚刚展开的明胶表面上,由于重力加速度,胶皮继续下降,使胶皮完全封口,药液便被包裹在胶皮里面,再加上表面张力作用,使胶皮成为圆球形,由于温度不断地下降,逐渐凝固成软胶囊。制备过程中必须控制药液、明胶和冷却液三者的密度以保证胶囊有一定的沉降速度,同时有足够的时间冷却。
b.压制法(滚模式压制法)
胶液分别由软胶囊机两边的输胶系统流出铺到转动的胶带定型转鼓上形成胶液带,由胶盒刀闸高低调整胶带厚薄。胶液带经冷源冷却定型后,由上油滚轮揭下胶带。自动制出的两条胶带,由左右两旁向中央共相对合的方向靠拢移动,在分别穿过左右各自上油滚轮时,完成涂入模剂和脱模剂工作,然后经胶带传送导杆和传送滚柱,从模具上部对应送人两平行对应吻合转动的一对圆柱形滚模间,使两条对合的胶带一部分先受到楔形注液器加热与模压作用而先黏合,此时内容物料液泵同步随即将内容物料液定量输出,通过料液管到楔形注液器,经喷射孔喷出,充入两胶带间所形成的由模腔包托着的囊腔内。因滚模不断地转动,使喷液完毕后的囊腔旋即模压黏合而完全封闭,形成软胶囊。压制法的关键控制点为:胶皮厚度、设备转速、胶盒温度、喷体温度、内容物装量、冷水温度等。
C. 干燥
压制后的软胶囊通过传送带送入预干转笼内,通过转笼旋转和风机吹风使胶囊囊壳的水分快速散失达到定型的目的,经预干后的胶囊放于托盘内并放于干燥隧道或干燥间内通过空调系统除湿干燥。预干的温度和时间、终干的环境温湿度是软胶囊干燥的关键控制点。
D. 拣丸
拣丸是控制软胶囊大小的一种方式,其操作简介如下:首先,在加料料斗中加入待拣产品;通过一个振荡器向直径分拣区加料,在此区域将粘连在一起的软胶囊剔除。接着通过一个倾角可以调节的胶囊分配单元分别引导软胶囊进入厚度分拣区的转辊轨道;两个转辊轨道之间形成一个梯形缝隙,由上到下逐渐加宽,利用设定的界定值将该梯形缝隙分为三个区域,然后通过转辊的运转,输送软胶囊分别进入相应的区域。
E. 洗丸
洗丸是通过乙醇或异丙醇等清洗溶剂将胶囊表层的油脂去除,洗涤形式主要分冲淋式和浸泡式,包括超声波技术应用。清洗后的软胶囊应充分晾干,让清洗溶剂彻底挥发,必要时可检测清洗溶剂的残留情况。
F. 印字
字模印字法:主要就是按文字或图案样刻在一硬质模上,舔上印油,在排列好的软胶囊表面像盖章一样将文字图案印在胶囊上面,由于印墨属于食品级并会快速挥发达到干燥后色印留驻产品上的目的。字模印字一般为单色且个别会模糊印字不清,因此其对字和图案的大小有一定要求范围。
喷墨印字法:喷墨印字法使用喷墨印字机技术,靠光感应到丸后而由特制喷嘴
细微喷射孔定量定位喷射出食品级色墨喷印在丸外表面上,墨会极其迅速地挥发去溶剂并干燥。喷墨印字机反应迅速,软胶囊排列速度有多快,其速度就多快,是非常有效的印字设备,相对字模印字机,速度快清晰度好,质量更好。由于喷嘴是平面喷射文字或图案,而丸是球拱曲面,所以边缘图案文字可能会走形,所以要特别注意软件的配选。
激光刻字法:是利用激光技术像刻图章般在软胶囊外表面阴(凹)刻下文字或图案,字体细度能达到0.005mm。使用该技术进行印字时各项参数的设计尤为重要,确保胶囊印字完好且不穿透胶皮影响产品质量。
G. 生产过程控制
溶胶:胶液制备终点应检测其黏度和水分。
软胶囊内容物(药液)制备:药液制备好后,应检查其外观,应均匀无异物;
必要时检测含量,应在规定的控制范围。
压丸:压丸过程应监测制得软胶囊的外观及粒重(平均粒重和单粒重量)。外观形状应与目标形状一致,且表面应光滑;装量的控制标准应结合成品装量差异(见《中国药典》通则 0103胶囊剂)及成品含量的要求适当收严。
干燥:干燥终点应检查软胶囊的外观和水分,外观应光滑、无粘连、裂痕等。
拣丸:拣丸过程应从拣丸设备合格产品区抽查软胶囊的外观,确认合格区产品大小及形状均符合规定。
洗丸:必要时,在软胶囊晾干后检测清洗溶剂的残留量,确保符合残留溶剂的控制要求。
印字:印学过程需要高频率检测产品外观,确保印字内容呢正确、清晰。
要点备忘
• 溶胶工序应严格控制物料的加入顺序、溶胶的温度、时间,脱气的真空度与时间;配制好的胶液应保存在保温容器中,在规定时间内使用。
• 内容物若为混悬液,压丸前应搅拌均匀,压丸过程也应持续搅拌,确保产品剂量单位均匀。
• 压丸过程需要密切关注胶皮的厚度与均匀度,高频率检查软胶囊的重量和形状,以确保压制的软胶囊均匀一致。
• 无论印字的字模,还是设置的印刷或刻印内容,均需由第二人复核,同时,印字过程需要频繁检查软胶囊外观,以确保印字内容的正确、清晰。
5.1.8 胶囊检重
背景介绍
为了更好地确保胶囊装量差异符合要求,可在胶囊灌装步骤之后进行100%重量检查。
技术要求
重量检查采用自动称重设备,设备上有多个轨道,每个轨道下连接一个微型称量单元,每粒胶囊通过检重轨道,快速地通过称重单元并被精确称量,粒重超限的胶囊被剔除至剔除箱中,粒重合格的产品则被收集至合格产品收集处。称量单元的准确性至关重要,应定期对其进行检查。
胶囊称重可和胶囊填充连续进行,也可作为一个独立的工序,以下为单独作为一个工序的生产过程。
生产过程
a. 检查准备
对用到的区域进行检查确认,包括设备设施完好,现场无和本批无关文件、产品等,温湿度符合要求,洁净物品、工具等在清洁消毒效期内。
领取待检重胶囊,核对并确认产品名称、批号、数量、质量状态等信息正确,产品在规定的暂存期内。
b. 上料
上料一般采用重力下料或真空上料方式,真空上料时需避免对胶囊造成损伤。
c.称重
每批生产前和生产结束,需对检重秤进行校准,同时对重量超限剔除功能进行确认。
d.清场
生产结束后,需计算本过程的物料平衡和收率并按存储条件进行暂存,最后对房间设备设施进行清理清洁。
要点备忘
•称重设备应定期校准,确保其精度和准确度满足生产需求。
• 根据胶囊的理论重量及控制标准要求设定合适的设备运行速度,并在每批生产前和生产结束确认剔除功能正常。
• 装量剔除范围应结合《中国药典》通则0103胶囊剂的要求及成品含量可接受标准,合理制定。
• 检重过程注意对环境温湿度的控制,避免温湿度过高,胶囊暴露时间过长,导致胶囊剂变软,发黏,膨胀,造成微生物的滋长。
5.1.9 包装
背景介绍
包装是为流通过程中保护产品,方便储运,促进销售,采用容器、材料和辅助物等按一定技术方法的操作活动。包装的作用具体如下:
•保护商品,免受日晒、风吹、雨淋、灰尘沾染等自然因素的侵袭,防止挥发、渗漏、溶化、沾污、碰撞、挤压、散失以及盗窃等损失。
。给流通环节贮、运、调、销带来方便,如装卸、盘点、码垛、发货、收货、转运、销售计数等。
技术要求
包装材料的选择需要考虑对产品在运输和存储中的保护,同时也要考虑成本。
在研发阶段通过实验确认产品对光、湿度等的稳定情况,选择合适的包材:例如对光敏感的,在材质上可选择遮光性的包材(如棕色或其他不透明的包材);对湿度比较敏感的产品,则可以考虑使用双铝包装。
周体制剂产品常用的包装方式有:瓶包装、泡罩包装和袋包装。
瓶包装设备一般由理瓶机、数粒机/粉未灌装机、旋盖机、封口机及贴标机等部分组成,且通常配备自动质控系统,如理瓶机的自动反吹功能,数粒机针对数粒错误、含有断片异常药瓶的剔除功能,旋盖机对旋盖高度异常药瓶的剔除功能,铝箔封口机对瓶盖缺铝箔药瓶的剔除功能,贴标机针对无标签、空白签、标签批号错误药瓶的剔除功能等,从而确保所包装产品数量正确,密封性符合要求。
泡罩包装根据封装材料不同,可分为铝塑包装、铝铝包装、纸铝包装等,可以是一条包装线满足上述多种材料要求,也可以是一种或两种。生产过程包括以下步骤:泡罩成型、药片填充入泡孔、铝箔覆膜封合、裁切,主要控制参数成型模加热温度和沖压成型的压力(如为双铝包装则为神压成型的压力)、热封温度及压力、包装速度等。泡罩包装机通常配备的质控系统有:覆盖膜信息识别系统,用于确认覆盖膜的正确性;药片填充后的照相剔除系统,用于剔除空药板、缺粒及含残缺片的药板、含颜色及形状异常药片的药板。
袋装包装生产过程包括以下步骤:制袋、灌装、封口、冲切。主要控制参数为灌装速度、小袋封合温度等。袋包装机通常配备的质控系统有:复合膜条码识别系统,用于确认复合膜的正确性;光标定位系统,用于确保每一个小袋印刷内容的完整性;灌装剂量的在线检重剔除功能,用于自动剔除重量异常的产品;冲切剔除系统,用于自动剔除冲切位置偏移的产品。
装盒机由下料单元、说明书折纸单元、包装盒供给单元、推舌单元等组成,全部由机械动作进行装盒。通常配备的质控系统有:对于说明书缺失、缺料、纸盒打不开等问题能自动检测并定位停机的功能;小盒及说明书识别码扫描与异常自动剔除功能,以保证小盒与说明书100%的正确性。
为了保证最小包装单元药品的可追溯性,已有多国对此有相应的规定,产品的追溯应满足注册当地的法规要求,例如我国的《药品追溯码标识规范》《药品追溯消费者查询结果显示规范》等;美国 DSCSA 供应链安全法案 Product IdentifiersUnder the Drug Supply Chain Security Act Questions and Answers Guidance for Industry;
欧盟反假药指令欧盟人用药品包装上安全特征的详细规则 European Parliament andof the Council by Laying Down Detailed Rules for the Safety Features Appearing on thePackaging of Medicinal Products for Human Use 等。药品追溯系统的组成主要有:条码或二维码生成,打印,读取,上传的计算机硬件和软件,扫描枪,打印机以及追溯码跟踪、查询、存储的信息化平台。
A. 包装过程
a.包材的领用、退回及处理
①包装材料的领用:根据待包装产品的数量计算出本批需用各种包材的数量,由生产主管制定批包装生产指令。包装岗位人员根据批包装指令到包材仓库领用包材,按指令以最少墊数箱备货,包材管理员与岗位操作员共同核对品名、规格、批号、数量,并填写相关记录。
②包装材料的退回:整批包装生产结束时,包材管理员和岗位操作人员一起称重或点数、核对品种后,指定托盘摆放。称重包材包括:铝箔、PVC、PE 膜、复合膜、烟膜。点数包材包括:塑料瓶、盖、盒、说明书、签、箱皮、纸托,核算物料平衡,贴好物料标签后退回。
③废包材的处理:所有废弃包材(包括已打印批号的剩余包装材料)由岗位操作员统计数量,在QA 监督下销毁并记录。
b.瓶包装
①理瓶:岗位操作员根据包装记录上的理瓶机生产参数进行设定,每批正式生产前应对参数进行核对。岗位操作员将瓶子倒入理瓶机内,通过理瓶机将瓶子理到传送带上,传送至数粒装置处进行灌装。理瓶机上的反吹功能非常重要,可有效避免异物被带人所包装的产品中。
②数粒装瓶:岗位操作员在数粒机上设定好对应产品的生产参数(如计数设定、数粒速度等)后,将待包装的产品倒人数粒机的料斗内,开启数粒机。设备带自动剔除功能时,应在包装开始前进行剔除功能测试,设备应可以自动剔除计数错误和有残片的药瓶。在包装过程中应周期性检查装量的准确性,以及测试剔除功能。
③旋盖:岗位操作员在旋盖机上设定好对应产品的生产参数(如旋盖轮速度等)后,将瓶盖倒人旋盖机的料斗内,开后旋盖机。设备带自动剔除功能时,应在包装开始前进行剔除功能测试,设备应可以自动剔除旋盖后瓶身高度不符合要求的药瓶。
在包装过程中应周期性检查所旋瓶盖的松紧度。
④封口:岗位操作员在封口机上设定好对应产品的生产参数后,开启封口机。
设备带有自动剔除不含铝箔衬垫的瓶盖功能时,需要在包装开始前对剔除功能进行测试。在包装过程中应周期性检查剔除功能,以及药瓶的气密性。
⑤贴标签:岗位操作员首先要核对标签版本的正确性。设备带有标签条码检测系统时,还应该开启标签条码检测功能,100%确认标签的正确性。将标签安装好后,正式开始包装前,需双人核对确认标签上打印的产品批号/生产日期/有效期信息正确。设备带有白动控制系统时,还应该开启并剔除无签、空白签以及标签批号信息不正确的瓶体,并对剔除功能进行测试。在包装过程中应周期性对剔除功能进行测试,并检查标签上产品批号/生产日期/有效期信息的正确性。
c.泡罩包装
岗位操作员首先要核对印字铝箔版本的正确性。泡罩包装设备带有条码扫描系统时,应开启条码扫描系统,100%确认铝箔的正确性。
先调整好设备参数(如包装速度、热封板温度等),设定好批号和效期,需双人核对确认板上打印的产品批号/有效期信息正确然后进行产品包装,在包装过程中应人工或者使用自动化设备检测并剔除缺片、有残粒或者空板的泡罩版,并且周期性对泡罩包装设备的剔除功能进行测试,通过 IPC抽查检查铝塑板的气密性。
d. 小袋包装
岗位操作员首先要核对复合膜版本的正确性。设备带有条码检测系统时,还应该启用该功能,100%确认复合膜的正确性。岗位操作员根据包装记录上的生产参数进行设定,每批正式生产前应对参数(如热封温度)进行核对。正式开始包装前,操作员需要对光标对版情况及灌装量进行调试,灌装量应确保能满足《中国药典》通则0104的要求;还需要双人核对确认标签上打印的产品批号/有效期信息的正确性。设备带有自动控制系统时,应该开启并剔除光标对版超过允许的偏差,批号信息不正确,装量异常或冲切位置偏移的小袋。在包装过程中应周期性对自动剔除功能进行测试,确保自动控制系统的有效性。
e.装盒
岗位操作员首先要核对印字包材(如药盒和说明书)版本的正确性。装盒设备带有自动说明书和药盒条码扫描系统时,应开启条码扫描系统,100%确认说明书和药盒的正确性。正式开始包装前,需要双人核对确认药盒上打印的产品批号/生产日期/有效期信息正确。设备带有药盒批号打印检测系统时,还应该开启并100% 检测并剔除批号效期打印不全或者缺失的药盒。在包装过程中应周期性检查标签上产品批号/生产日期/有效期信息的正确性,药盒中的说明书和泡罩板等数量正确。盒装线还应该配备检重剔除系统,剔除缺说明书、缺药板的药盒。
f. 药品追溯码关联
药品的最小销售单元上预印或在线打印药品追溯码,中包和大箱上的追溯码在线打印。在药品追溯码赋码系统中扫描各级追溯码,使各级包装单元(小盒、中包、大纸箱)的追溯码建立关联关系。任务结束后,上传关联关系至追溯码系统。
g.裹包、装箱
包装员在裹包机上设定好对应产品的生产参数后,开启裹包机。应检查每裹包的外观是否整齐,产品批号/生产日期/有效期信息是否正确后装箱,应确认纸箱的品名、规格、数量、产品批号/生产日期/有效期信息是否正确,正确无误后封箱。
B. 包装过程控制
应检查、检测以下关键质量指标:
• 产品和包装材料是否正确,领料和上机人工确认,在线监控装置的功能开机、关机,过程中确认。
• 打印信息是否正确:包装开始需双人确认产品批号、生产日期、有效期信息的正确性,包装过程中、结束均需确认打印信息的正确性、完整性和可读性。
• 包装是否完整:包装开始、结束时应抽查气密性,包装过程中应阶段性抽查气密性,另外,中间过程参数调整或意外停机可能影响到产品气密性时,均应抽查。气密性检测方法参照GB/T 15171(《软包装件密封性能试验方法》)或ASTMD3078(《气泡排放测定软包装中泄漏的标准测试方法》)等,所用方法的有效性应进行确认。
• 装量或数量:包装的开始、中间过程参数调整或意外停机、结束时应抽查产品装量、数量的正确性,可通过称重或人工计数等方法。
• 印字包材应上锁管理,生产前领取时需要核对包材的正确性。
• 主要的印刷包材(如说明书、小盒等)应印有专属条码,包装设备尽可能配备相应的条码扫描及剔除功能,且包装过程需要定期对上述功能进行确认,以有效避免混淆的发生。
• 理瓶机应配备反吹功能,避免异物带人所包装产品中。
• 数粒机数粒的正确性及对缺损片的剔除功能,旋盖机的旋盖高度异常剔除功能,铝箔封口机的缺铝箔剔除功能及封口气密性应在包装过程定期确认,以保证装量正确,密封完好。
• 泡罩包装机尽可能配备条码识别功能,摄像剔除功能,且应在包装过程定期进行确认,以保证包装质量符合要求。
• 裝盒机应尽可能配备条码识别剔除功能,批号效期检查剔除功能,检重剔除功能等,且应在包装过程定期进行确认,以保证包装质量符合要求。
•包装全过程均需注意所用包材和打印信息的正确性,包装结束需关注标签、说明书等印刷包材的数量平衡,剩余已打印批号印刷包材应在 QA 监督下销毁。
5.2 技术转移
背景介绍
技术转移的目的是系统全面地将产品从研发转移至生产,或在不同生产地点间转移,以实现产品的工艺与质量得到重现目标,为产品实现商业化或产能扩大提供基础。
技术转移通常包括新产品从研发向生产转移;产品在场地内或者不同的生产场地之间的转移。
技术转移,尤其是不同公司之间的技术转移,具有法律和经济影响,其中可能包括知识产权、利益冲突和保密协议等。因此,应在规划和实施转移之前和期间解决此类问题。
企业应组建技术转移团队,建立技术转移规程,来管理和实施各种类型的技术转移,以确保各类技术转移的有序和可控。技术转移通常按照项目进行管理,一般分为以下实施步骤:
A. 技术转移的项目启动
在技术转移之前,转出方应对技术转移的可行性进行评估,包括技术、质量、监管和法律等方面的评估。技术转移评估通常由对拟转移的产品具有知识和经验的专业技术人员参与。评估的内容包括但不限于以下:
• 对接收方的条件、技术水平、质量管理情况进行现场考核,确认其具有完成受托工作的能力,并能保证符合各项法规的要求。
•评估接收方厂房设施是否满足拟转移产品的生产要求。
• 拟转移的品种与原有品种的共线风险评估,确认是否共线。
•评估接收方的生产设备、检测仪器与转出方的差异,是否满足拟转移产品的生产和检验要求,确认需要补充的硬件(设备、模具、备件等)投入情况。
• 评估接收方企业的稳定发展能力。
• 评估接收方生产业务的可持续性以及转移后工艺放大的能力。
• 评估技术转移中将涉及的生产监管事项变更和注册管理事项变更。
• 评估技术转移中涉及的知识产权的管理等。
• 评估接收方所在地相关法规(如药品监管、EHS、废物处理等)的特殊要求。
• 评估转移产品的产能和成本预算对比。
技术转移评估小组完成技术转移的可行性评估后,由转出方和接收方公司高层对产品技术转移申请做出最终决定。
B. 技术转移的组织和规划
a. 组建技术转移团队
批准转移后,转出方和接收方应组建技术转移团队,明确团队成员的职责,通常要求以书面形式确定转移团队成员及各自的电话、邮件等联系方式,成员通常包括转出方与接收方的技术转移项目经理及质量管理、生产技术、分析方法、法规注册、EHS、法规事务等方面的技术转移小组成员。
b.技术转移项目计划
转出方和接收方技术转移项目经理共同拟定技术转移项目计划和进度表,明确各项工作的时间节点要求,确定转移各步骤的接收标准,制定双方定期的沟通交流机制。技术转移项目计划应由转出方和接收方共同审核和批准。
c.签署委托生产合同和质量协议
转出方和接收方应签署书面的委托生产合同和药品委托生产质量协议,落实药品管理法律法规及药品生产质量管理规范规定的各项质量责任,保证药品生产全过程持续符合法规要求。
委托生产合同的内容包括委托生产的法律依据,合同双方的基本要求和职责,货期、加工费用和付款方式,验收标准,合同终止条件等。
药品委托生产质量协议的具体内容要求应遵照GMP(2010年修订)和国家药监局发布的关于药品委托生产质量协议指南。质量协议的起草应由持有人和受托方的质量管理部门及相关部门共同参与,其技术性条款应由具有制药技术、检验专业知识和熟悉GMP的主管人员拟订。质量协议双方应当遵守药品管理的法律法规和技术规范要求,履行 GMP 规定的相关权利和义务,以及质量协议的各项规定,并各自依法承担相应的职责。
C. 技术转移的实施
a.技术文件准备和传递
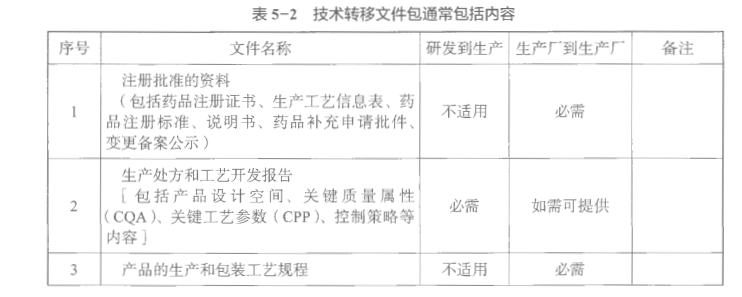
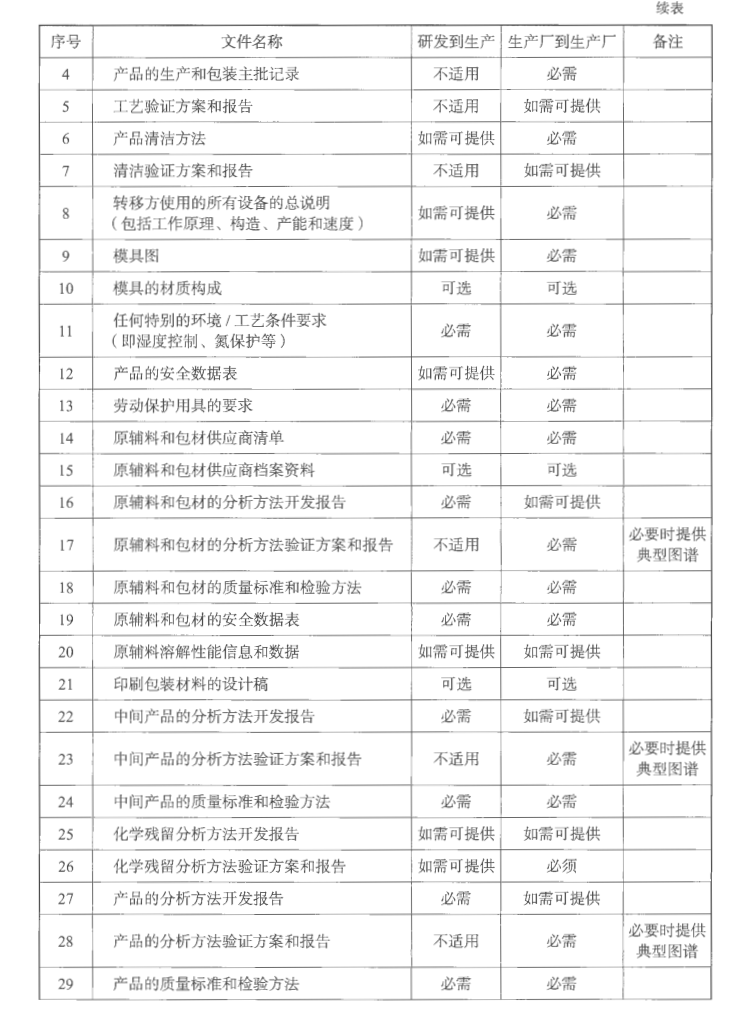
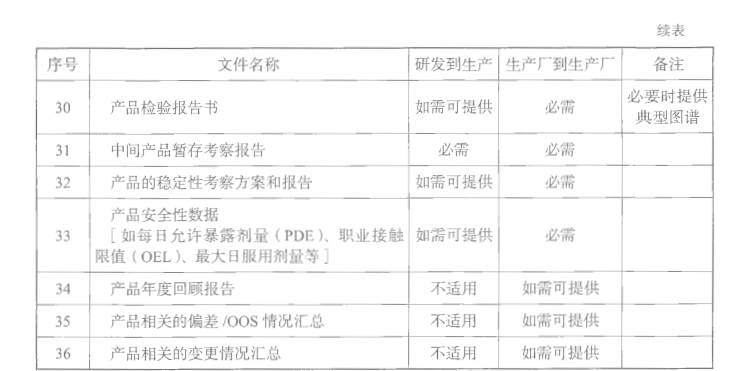
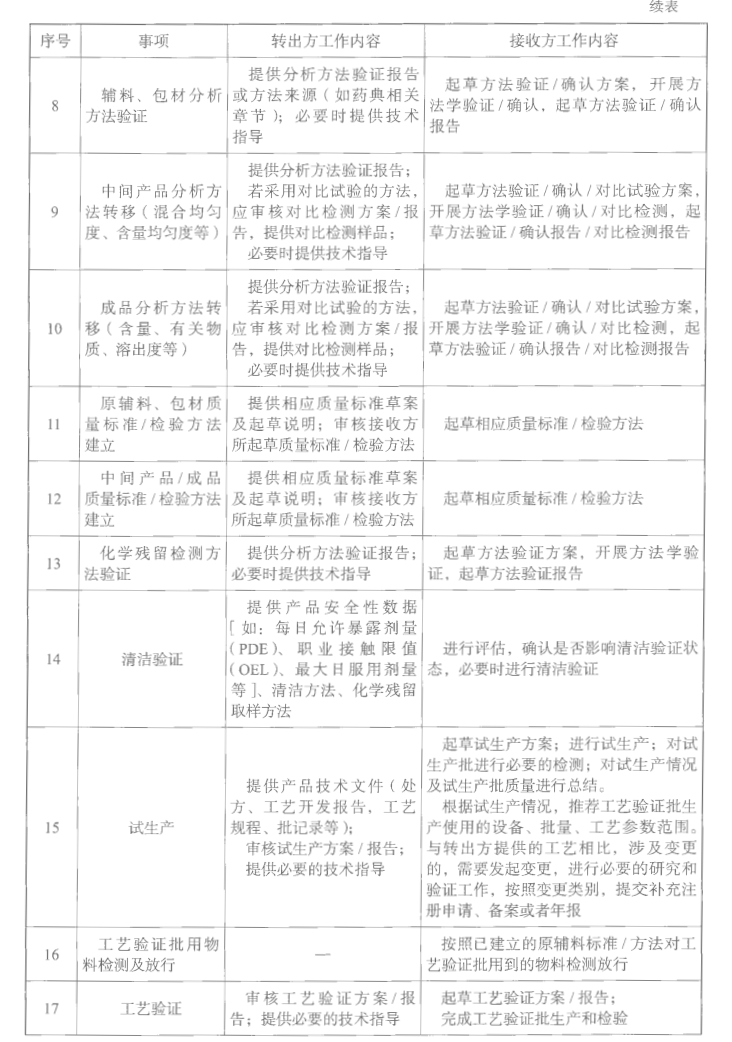
转出方应当向接收方提供项目转移所有必要的技术资料,以使接收方能够按照药品注册和其他法定要求正确实现所转移的技术。技术转移文件包通常包括内容见表5-2。
知识传递:在技术转移实施前,转出方应对接收方的技术人员进行培训,使接收方充分了解产品的生产工艺和检验方法。转出方在进行关键工艺步骤期问,由接收方派人员去转出方进行现场学习,或是接收方在进行转移活动过程中,由转出方派人前来接收方给予现场指导。
b. 差距分析
收到转出方转移的产品技术文件后,接收方应运用风险管理工具进行差距分析,通常包括:多产品共线生产可能存在的风险,新引人产品的清洁要求是否影响日前清洁验证状态;生产设备和设施及其验证状态是否满足新转人产品生产工艺及控制的要求;检测仪器及其验证状态是否满足转移项目涉及的物料、中间产品及成品的检测要求;物料仓储条件(有无特殊温湿度要求)、生产厂房环境(有无防爆、除尘功能)是否满足转移项目要求;转移前后生产批量、生产设备变化可能引起工艺参数的变化等。接收方依据差距分析结论,对不同风险级别分配不同资源和时间,制定详细方案,明确需要采取的降低风险的措施。
c. 技术转移项目计划(或技术转移方案)
接收方技术转移小组按管理程序要求制定技术转移项目计划(或技术转移方案),依据差距分析结论,明确此项目技术转移过程中需要确认和验证的内容、时间节点、负责人等。
依项目计划(或技术转移方案),准备相应方案,实施技术转移。
d. 试生产批
根据技术转移文件和生产场地的设备设施情况,接收方负责准备试生产的方案,在试生产方案中应该规定数据的收集和评估要求,报转出方批准。试生产批次通常为中试规模和商业化规模,一般至少有一批商业化规模。
e. 分析方法转移
分析方法转移是保证不同实验室之间获得一致、可靠和准确检测结果的一个重要环节,同时也是对实验室检测能力的一个重要评估。分析方法转移可通过多种途径实现。最常用的方法是相同批次均一样品的比对试验或专门制备用于测试样品的检测结果的比对试验。其他方法包括:实验室间共同验证、接收方对分析方法进行完全或部分验证和合理的转移豁兔。分析方法转移实验、转移范围和执行策略制订要依据接收方经验和知识、样品复杂性和特殊性、分析过程的风险评估。
分析方法转移前,双方通过讨论达成共识并制订文件形成转移方案。在分析方法转移方案中应明确分析方法转移成功的评价标准。当分析方法转移成功后,双方应共同起草方法转移报告,报告应提供与可接受标准相关的实验结果,确认接收方已具备使用所转移分析方法的资格(《中国药典》指导原则9100分析方法转移指导原则)。
f.工艺验证
根据试生产批的结果和工艺验证指南及变更指南的要求,决定所需的工艺验证工作。工艺验证一般要求为连续生产的三批,且生产工艺应该是一致的。在工艺验证方案中应该规定数据的收集和评估要求(包括使用的统计学方法,溶出曲线的对比要求等),以及工艺验证通过的条件。
g.清洁验证
根据清洁验证相关的指南和接收方管理规程的要求进行书面评估,决定所需的清洁验证工作。
h. 稳定性研究
技术转移的工艺验证批产品应进行加速和长期的稳定性考察及一些特条件稳定性考察。如果产品包括多个剂量规格和包装规格,可以参考ICH QID,采用括号法或矩阵法设计稳定性考察方案。产品稳定性的考察应充分考虑技术转移过程所有注册管理事项变更的申报要求以及商业化的要求。
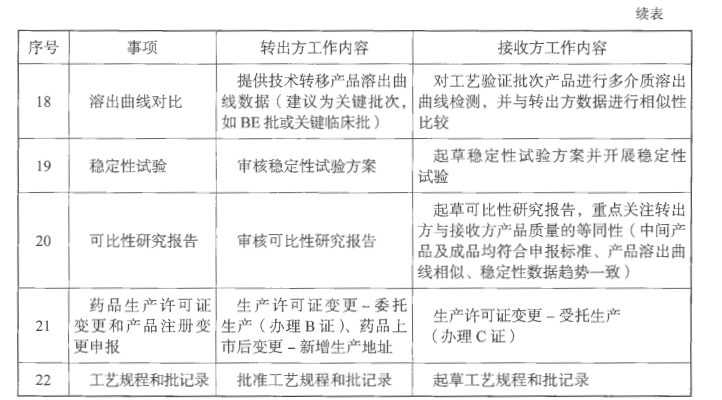
i. 可比性研究(质量等同性研究)
对于已获批的产品,技术转移的转出方和接收方应进行产品转移前后的质量等同性研究,研究内容包括对比产品技术转移前后的产品处方组成、生产工艺和设备、产品批量、产品工艺参数和过程控制标准、物料的供应商和物料的接收标准、中间产品的质量标准和检验数据、成品的质量标准和检验数据(包括成品全项检验结果、混合均匀度和含量均匀度、溶出曲线等质量研究数据)、稳定性数据等。除此之外,需要提醒如有刻痕的药片,需根据《化学仿制药口服片剂功能性刻痕设计和研究技术指导原则(试行)》进行对比研究。
j.变更事项
技术转移中还需要考虑相关的生产监管事项的变更和注册管理事项的变更工作和办理时限要求,具体按照《药品生产监督管理办法》《药品注册管理办法》《已上市化学药品药学变更研究技术指导原则》等法规要求执行。
生产场地的变更需要进行的研究和验证工作包括内容如下:
。说明变更的具体情况和原因,对变更后相关.工序进行研究和(或)验证。
•比较新旧场地处方和生产工艺、生产过程控制等情况。比较新旧场地生产设备情况,包括生产厂家、型号、材质、设备原理、关键技术参数等,并说明变更前后生产设备与生产工艺的匹配性。
• 提供变更后一批样品的批生产记录。
• 对变更前后的样品进行质量对比研究,重点证明变更前后样品的溶出曲线、杂质谱、关键理化性质等应保持一致,并符合相关指导原则要求。
•对变更后生产的1~3批样品进行检验,应符合质量标准的规定。
• 对变更后1~3批样品进行加速和长期稳定性研究,中报时提供3~6个月稳定性研究数据,并与变更前药品稳定性情况进行比较。变更后样品的稳定性应不低于变更前。
如变更场地的同时,其处方、生产工艺和生产设备、产品批量、质量标准和分析方法、物料供应商等发生变更,需按照相关的变更指导原则和变更规程,如《已上市化学药品药学变更研究技术指导原则(试行)》相关章节要求进行关联变更的研究,各项变更应单独发起,所有该项目技术转移的关联变更可在项目验证主计划中明确。
k.技术转移过程偏差处理
技术转移过程中发生的偏差,接收方应按照质量协议要求及时反馈给转出方,双方进行充分的技术交流,共同对偏差进行调查、评估并制定纠正预防措施。
技术转移过程中执行的各项活动的记录,应遵循质量协议和记录管理规程的要求,确保数据的完整可靠。
D. 技术转移评价
技术转移活动结束后,转出方和接收方应共同完成一个技术转移报告以关闭整个项目的技术转移。这个报告应评估转移前制定的转移计划、转移成功标准及风险减低措施的实施情况,描述得到的经验教训并深入分析,以便为将来产品工艺改进提供有力的背景知识支持。必要时,还需要在这个阶段根据风险评估制定一个持续确认的计划,以监控转移的技术在持续生产中的性能表现。
实例分析
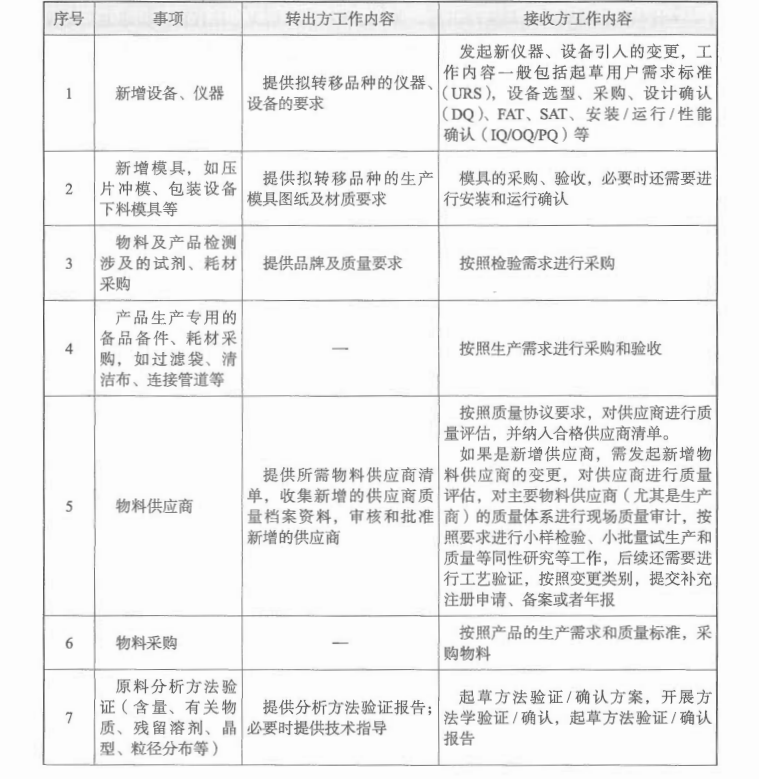
药品上市许可持有人已获批自行生产药品 xxx片(A地),计划增加委托生产地址(B地),生产场地需从A地转移至B地,技术转移所涉及的具体工作及可能存在的关联变更如下:
固体制剂技术转移的目标是要使接收方生产出的产品与转出方产品质量等同,疗效一致,故最关键的是确保接收方生产的产品符合注册标准,批内和批间含量均匀性,溶出曲线与转出方产品提供数据相似。因固体制剂工序多,易产尘,设备共用,产品共线风险和交叉污染风险也是技术转移过程中需要重点关注的因素。


