3.1 概述
法规要求
药品生产质量管理规范(2010年修订)
第三条 本规范作为质量管理体系的一部分,是药品生产管理和质量控制的基本要求⋯
第一百八十四条 所有药品的生产和包装均应当按照批准的工艺规程和操作规程进行操作并有相关记录⋯⋯
第一百八十五条 应当建立划分产品生产批次的操作规程,生产批次的划分应当能够确保同一批次产品质量和特性的均一性。
第一百八十八条 不得在同一生产操作间同时进行不同品种和规格药品的生产操作,除非没有发生混淆或交叉污染的可能。
第一百九十条 在干燥物料或产品,尤其是高活性、高毒性或高致敏性物料或产品的生产过程中,应当采取特殊措施,防止粉尘的产生和扩散。
第一百九十一条 生产期间使用的所有物料、中间产品或待包装产品的容器及主要设备、必要的操作室应当贴签标识⋯…
第一百九十四条 每次生产结束后应当进行清场,确保设备和工作场所没有遗留与本次生产有关的物料、产品和文件。下次生产开始前,应当对前次清场情况进行确认。
第一百九十七条 生产过程中应当尽可能采取措施,防止污染和交叉污染,如:
(一)在分隔的区域内生产不同品种的药品。
(二)采用阶段性生产方式。
第一百九十九条 生产开始前应当进行检查,确保设备和工作场所没有上批遗留的产品、文件或与本批产品生产无关的物料,设备处于已清洁及待用状态。检查结果应当有记录。
药品生产监督管理办法(2020年版)
第二十四条 从事药品生产活动,应当遵守药品生产质量管理规范,按照国家药品标准、经药品监督管理部门核准的药品注册标准和生产工艺进行生产••生产、检验等记录应当完整准确,不得编造和篡改。
第二十六条 从事药品生产活动,应当遵守药品生产质量管理规范,建立健全药品生产质量管理体系,涵盖影响药品质量的所有因素,保证药品生产全过程持续符合法定要求。
背景介绍
口服固体制剂作为应用最为广泛的药品剂型,包括颗粒剂、混悬剂、片剂和胶爽剂等(各剂型定义参考《中国药典》四部。)。
颗粒剂系指原料药物与适宜的辅料混合制成具有一定粒度的干燥颗粒状制剂。
颗粒剂可分为可溶颗粒(通常称为颗粒)、混悬颗粒、泡腾颗粒、肠溶颗粒、缓释颗粒和控释颗粒等。颗粒剂的基本质量要求是干燥、颗粒均匀、色泽一致,无吸潮、软化、结块、潮解等现象。颗粒剂宜密封,置干燥处贮藏。
口服混悬剂系指难溶性固体原料药物分散在液体介质中制成的供口服的混悬液体制剂。非难溶性药物也可以根据临床需求制备成干混悬剂。
片剂系指原料药物与适宜的辅料制成的圆形或异形的片状固体制剂。片剂以口服普通片为主,另有含片、舌下片、口腔贴片、咀嚼片、分散片、可溶片、泡腾片、阴道片、阴道泡腾片、缓释片、控释片、肠溶片与口崩片等。
胶囊剂系指原料药或与适宜的辅料充填于空心胶囊或密封于软质囊材中制成的固体制剂。胶囊剂可分为硬胶囊和软胶囊,根据释放特性不同还有缓释胶囊、控释胶囊、肠溶胶囊等。胶囊剂可以掩盖药物的味道、提高稳定性等;液态药物固体剂型化;缓释胶囊技术可延缓药物的释放时间,控释胶囊技术可实现定向释放或者定位释放。缓控释胶囊生产过程和普通胶囊生产有一定差异,与其相关的生产质量管理可参照本分册附录( 附录)。
附录)。
硬胶囊(通称为胶囊)系指采用适宜的制剂技术,将原料药物或加适宜辅料制成的均匀粉末、颗粒、小片、小丸、半固体或液体等,充填于空心胶囊中的胶囊剂。
通常来讲,不论何种剂型,口服周体制剂的生产,除遵守《中华人民共和国药品管理法》《药品生产质量管理规范(2010年修订)》基本要求外,结合口服固体制剂容易产尘、共线和工序不连续的特点,一般应重点从粉尘控制或防护、标识管理、共线生产、足够的中间体物料储存区域或者有效的隔离措施等方面防止污染、交叉污染、混淆和差错。一般应符合以下基本原则:
通常不同产品(含不同品种、不同规格、不同包装规格)或者同一产品不同批次的操作不能同时在同一个房间内进行,除非操作有足够的物理隔断或者密闭生产等控制措施,确保不同产品间没有混淆、差错或交叉污染的危险。
在整个工艺操作过程中,所有的物料、容器、主要设备,包括使用的房间和包装生产线都应该进行标识,标识内容应该标明产品名称、规格、批号(编号)、生产工序等内容。
共线生产应进行共线生产的风险评估,评估内容至少应该包括共线产品生产可行性(结合产品从用法用量、功能主治、中西药分类、协同或拮抗情况、儿童和妇女是否可以用药、不良反应、注意事项等)、相互影响程度、清洁验证或确认(基于API 进行确认)等内容。必须避免一种物料/产品被另一种物料/产品污染或交叉污染。污染或交叉污染的可能性来自于生产过程中物料和产品释放时不受控的粉尘、气体、颗粒、蒸汽、飞沫或有机体、设备上的残留、侵入的昆虫以及操作者的服装、皮肤等,这种危险的严重程度因污染物类型和被污染产品的不同而不同。应采取合适的技术或管理措施避免交叉污染的发生。例如:
• 采用专用和独立的厂房、生产设施和设备(如青霉素、卡介苗等)。
• 使用已知有效的清场和防污染程序,按照已经验证的清洁程序进行清洁,实施阶段性生产(时间间隔)。
• 设备使用清洁状态标识,测试活性成分残留。
• 具有合理设计的气闸、压力差和供风排风系统。
• 减少因没有处理或没有完全处理的空气进入生产区而造成的污染。
• 在接触物料或产品的区域内穿戴适当的洁净服和用品。
• 生产中使用“密闭系统”。
• 应根据 SOP 定期检查防交叉污染措施的实施情况及其有效性。
• 生产车间不同用途的储存间应有足够的面积,确保不同种类的物料和产品能够妥善存放。房间必须洁净、干燥并维持在适当的温度和湿度范围。
本章节以常见的口服固体制剂(颗粒剂、片剂和胶囊剂)的生产质量管理为重点,供有需要的企业参考,特殊缓(控)释制剂见本指南附录。颗粒剂的生产工序包含在片剂生产工艺过程中:从配料到整粒、混合后直接包装,只是不经过压片工艺,因此本指南不再单独介绍颗粒剂的生产质量管理要求,下面分别介绍片剂和胶囊剂的基本生产工艺过程。
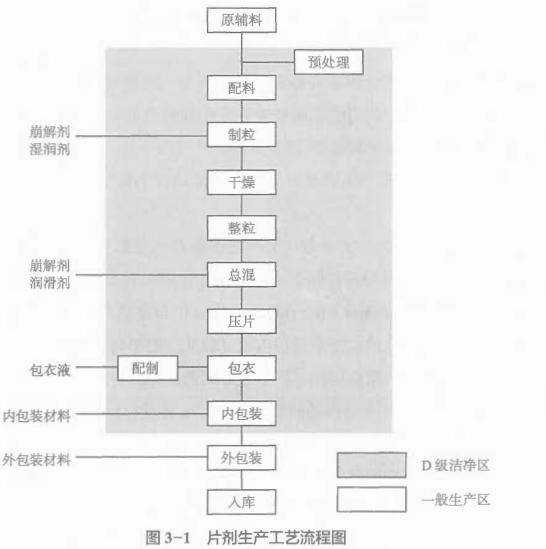
3.1.1 片剂生产工艺过程
片剂生产工艺流程包括原辅料预处理、配料、制粒、干燥、整粒、混合、压片、片剂的包衣以及内包装、外包装等十个步骤,见图3-1(本部分的生产工艺流程步骤不是通用的,企业在生产管理和确定工艺步骤时要根据所用原辅料的性质和生产工艺特点,确定与企业实际相符的工艺路线设计)。
3.1.1.1 原辅料预处理
合格物料应经缓冲区脱外包装或经适当清洁处理后进入备料室。原辅料预处理的环境和空气洁净度要与注册工艺一致,并有捕尘和防止交叉污染措施。
原辅料预处理前应目检、核对重量,液体原料必要时应过滤。
称量用衡器应定期校验,做好校验记录,并在已校验的衡器上贴有校验合格标识,使用前应由操作人员进行检查或校准。
原辅料的粉碎、过筛等预处理过程,应关注以下控制要点:
• 原辅料应按照规定的工艺选用筛网过筛或粉碎。
• 预处理前核对品名、批号和重量等信息。预处理后的原辅料应贴有标签,写明品名、代号/批号、重量、日期和操作者等信息,用于追溯物料信息。
• 根据物料的性质,确定预处理后物料的储存方式和储存效期。
•预处理前后,物料应分区存放,并有明显状态标识(如:处理前后物料批号发生变化,不同状态物料“代码/批号”不同等)。
• 过筛和粉碎设备应有粉尘控制措施,如设备安装吸尘装置,含尘空气经处理后排放。
• 滤网、筛网/筛锣每次使用前后,应检查其磨损和破裂情况,发现异常要调查原因并及时更换。
• 过筛和粉碎设备可配备有除金属装置,去除金属屑或金属异物。
3.1.1.2 原辅料称量、配料
称量操作开始前应确认称量环境温湿度、压差、局部除尘装置等符合工艺要求。
称量用天平/秤应按规定使用前完成校验且在校验有效期内使用。物料如集中称配,原辅料的称量环境要与生产环境空气洁净度级别一致。
称量前检查物料外观,无明显可见异物、结块等不良情况,发现不良情况及时上报质量部门。
称量操作需按照工艺处方要求/生产指令称量,先称量辅料,后称量原料/活性成分物料;或者原辅料分操作间进行称量操作,最大限度地減少交叉污染的风险。
配制的每一物料及其重量或体积应当有他人独立进行复核并确认。称量过程采用完全自动化或计算机化设计的,整个过程应经过验证,能够有效防止差错发生。
称量、配料过程用工器具应经过清洁验证或确认,必要时应根据活性成分专用。
称量、配料后的物料应与称量前物料分开存放并进行标识,至少写明物料品名、批号、重量、日期和操作者姓名等信息。
配料前应先核对原辅料品名、规格、代码、批号、生产厂家、包装情况。
处方计算、称量及投料必须复核,操作者及复核者均应在记录上签名。配料过程中处方计算、称量、投料采用完全自动化或计算机化设计的,整个过程应经过验证。
3.1.1.3制粒
使用的容器、设备和工具应洁净、无异物。
投料过程应尽量减少粉尘产生,房间可保持相对负压,可采用真空上料或者无尘投料等方式,投料顺序需符合预定工艺的要求,采用高速湿法制粒机制粒时,按工艺要求设定预混、制粒时间、搅拌转速、切刀转速以及加入黏合剂的量。当混合制粒结束时,将制粒机锅的内壁、搅拌桨和盖子上的物料尽量刮干净,以减少损失。
根据工艺要求,如使用可燃性溶媒,制粒及相关区域应注意防爆。湿法制粒机与流化床设计时应具备抗爆能力,常用的防爆方式有闷爆、泄爆与抑爆。同时岗位上应配备有防爆型仪表和防爆型电气设备,安装有浓度检测报警装置。如使用管路输送有爆炸隐患的风险物料,应严格控制投放物料的速度。设备以及管路等之间设防雷、防静电接地,严格控制房间粉尘等。
3.1.1.4 干燥
采用流化床干燥时所用的空气应净化除尘,达到D级的要求,同时考虑工艺要求确定是否需要增加除湿的单元,排出的气体要有防止交叉污染的措施。操作中随时注意流化室温度、颗粒流动情况。流化床干燥用滤袋应定期清洗,定期进行完整性检查。滤袋应按活性成分专用,或经评估共用没有造成交叉污染风险。
采用干燥箱干燥时应按T.艺要求控制干燥温度、真空度、铺盘厚度等参数,防止颗粒融熔、变质,并定时记录温度。
3.1. 1.5 整粒
整粒机应尽量采用密闭装置组织生产或采用有效的除尘装置。整粒机的落料管路可选择安装金属探测器或采取其他有效的手段和方法,除去意外进入颗粒中的金属异物。
对于颗粒剂按照注册T.艺需要对制粒后的物料过筛处理的,除按照规定选择筛网/筛锣外,对于过筛后的细粉严格按照工艺规定处理,如是否重新制粒等。
3.1.1.6 总混
颗粒经干燥、整粒后经物料传输管道或其他方式转移至混合桶内,转移过程应采取措施,減少粉尘暴露。可采用翻滚型混合机、容器型混合机和搅拌型混合机等混合机进行总混,每混合一次为一个批号。
混合机内的装量应经过确认。混合好的颗粒装在洁净的容器内,容器应有标签,写明品名、规格、批号、重量、日期和操作者等信息。
3.1.1.7 压片
压片室应对洁净走廊保持相对负压,粉尘由吸尘装置排除。
设有单独的模具室,专用于模具的存放与管理。由专人负责冲模的核对、检测、维修、保管和发放。建立冲模使用档案和沖模清洁保养管理制度,保证冲模质量,提高冲模使用率。
冲模使用前后均应检查品名、规格、光洁度,检查有无凹槽、卷皮、缺角、爆冲和磨损,发现问题应追查原因并及时更换。为防止片重和厚度差异,需控制冲头长度。
如采用刻字冲头,使用前必须核对品名、规格,冲头应字迹清晰、表面光洁对于功能性刻痕,要核对刻痕完整。
压片前应试压,并检查片重、硬度、厚度和外观等指标,必要时可根据品种要求,增测崩解度、脆碎度、含量、溶出度或均匀度等。符合要求后才能开启压片机,按照规定速度范围连续压片,压片过程中应定时抽样检查平均片重、外观以及其他相关指标,抽检频次和项目应根据设备确认状态以及产品情况评估确定。
压片机的加料宜采用密闭加料装置,减少粉尘飞扬。压片机应有吸尘装置,除去粉尘。
盛放半成品的容器应干燥清洁,容器应有标识,写明品名、规格、批号、重量、操作者和日期。
压片过程中取出供测试的样品,一般情况下不得重新放回原容器中。
3.1.1.8 包衣
包衣锅内干燥用空气应经过滤,并符合D级要求。
包衣使用有机溶剂的包衣室和包衣液配制室必须符合防火、防爆要求。
包衣用的糖浆须用纯化水( 纯化水)配制、煮沸、滤除杂质。食用色素须用纯化水溶解、过滤,再加人糖浆中搅匀,并做好包衣液的配制记录。
纯化水)配制、煮沸、滤除杂质。食用色素须用纯化水溶解、过滤,再加人糖浆中搅匀,并做好包衣液的配制记录。
包衣液配制前应核对包衣粉品名、型号、颜色等与工艺要求一致。包衣前和包衣过程中包衣材料应充分分散均匀。包衣时,应根据工艺控制包衣锅进风温度、物料温度、出风温度、锅体转速、压缩空气的压力、进风量、锅内负压、喷枪的长度和角度等参数,按工艺要求控制包衣片增重,必要时检测包衣片的水分。采用流化床包衣时,应根据工艺控制进风风量、进风温度(必要时控制进风湿度)、喷液速度、雾化压力、物料温度,按照工艺要求控制包衣增重、水分等指标。
包衣完毕装有包制好的半成品的盛器应有标签,写明品名、规格、批号、重量、日期和操作者等。
3.1.1.9 内包装
直接接触药品的包装材料和容器,应当符合药用要求。塑料瓶、袋、铝塑材料等内包材的外包装应严密,内包装袋应清洁干燥,必要时采取适当方法对内包装袋外表面进行清洁消毒。
内包装设备根据产品特性,可配备有吸尘装置,排除粉尘。设备可配备在线照相、在线称量等剔废和报警功能,确保内包装质量符合要求。
生产过程中应规定定期检查的频次和项目(包装密封性和外观等),保证生产过程产品的质量合格。
应设模具室,由专人负责模具的核对、检测、维修、保管和发放。建立模具使用档案和清洁保养管理制度,保证模具质量,提高模具使用率。
常用的内包装形式有泡罩包装、瓶装、颗粒分装等,下文以铝塑包装、塑料瓶装,颗粒分装为例,简述内包装过程的要求。
a. 铝塑包装
应建立批号打印钢字管理制度,规定尺寸要求,对钢字的发放、使用、更换进行管理,保证使用的准确性及字体的一致性。
在生产前核对待包装产品和所用包装材料的名称、规格、重量、质量状态,且应与工艺要求相符。
生产前应按规定调节设备成型温度、热封温度、批号打印温度及位置等,调节剔除功能,确认剔除的准确性,检查批号、版型及密封性合格后进行正式生产。生产过程中应规定定期检查的频次、项目,保证生产过程产品的质量合格。
b.塑料瓶包装
包装材料应无异物、容器洁净无粉尘。瓶、盖规格应符合要求,确保包装的严密性。
在生产前核对待包装产品的名称、批号、规格、重量、质量状态,且应与工艺要求相符。
塑料瓶包装应设置数粒装置,可根据产品特点,必要时配备干燥剂投放装置、扭力矩检测装置等。确保内包质量符合要求。
生产前确认数粒计数准确、封口严密、包装材料规格正确,确认剔除的准确性,合格后进行生产。生产过程中应规定定期检查的频次、项目(如数粒准确性、包材完整性、封口严密度等),保证生产过程产品的质量合格。
c.颗粒分装
在分装前核对颗粒的品名、规格、批号、重量,并检查颗粒的外观质量和包装材料规格、颜色应与工艺要求相符。
生产前确定合适的分装速度(该速度应在验证确认的范围内),调节设备纵封温度、横封温度、批号打印功率(激光)及位置,调节剔除功能,加入药品进行试生产,确认剔除的准确性,检查装量、批号、外观及密封性合格后进行正式生产。生产过程中应规定定期检查的频次,保证生产过程产品的质量合格。
应定期检查内包装的密封性,确保产品的气密性符合要求。颗粒剂/干混悬剂分装过程中,需要定时检查分装剂量的准确性。
3.1.1.10 外包装
对包装标签的品名、规格、批号、生产日期、有效期等必须复核校对。包装结束后,应准确统计标签的使用数、取样数、损坏数及剩余数,与领用数相符。剩余标签和残损标签按规定处理。
包装全过程应随时检查包装质量。要求贴签端正、批号正确、封口纸平整严密、所装的PVC泡罩和铝箔热压熔合均匀、装盒完整、装箱数量准确及外箱文字内容清晰正确。生产过程中应及时扫描药品追溯码,产品放行后应及时上传追溯码信息。
采用自动化包装生产线时,为避免出现系统性质量问题,可利用网络技术,人工智能等技术实现产品的主动质量控制。根据包装工艺及质量控制需求可配备伺服过程放料、缺料检测、多料检测、说明书检测、缺盒检测、折舌检测、剔废、在线称重等在线监测功能,确保设备关键工艺控制点处在在线检测状态。生产线设计要确保各工位动作可实现电子自动同步性,确保设备各功能之间以及各种技术指标参数的吻合程度较好,可以实现与任何前后道工序设备自控链接,各功能之间自动联接、自动检测控制运行。
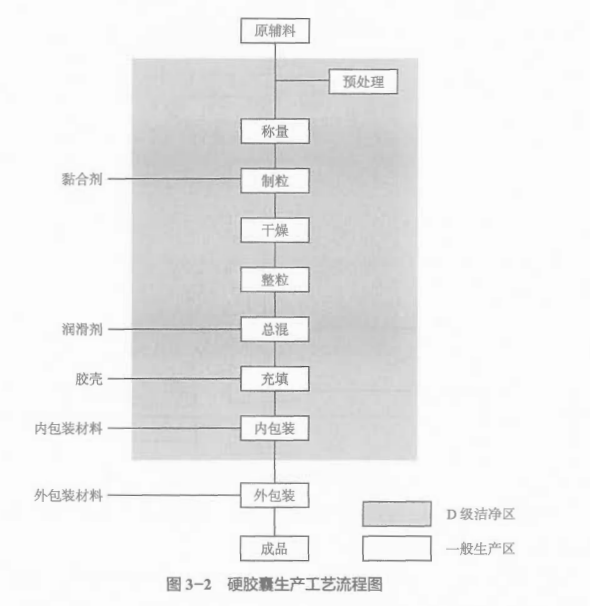
3.1.2 硬胶囊的生产工艺流程
硬胶囊剂生产工艺流程(图3-2)包括原辅料预处理、称量、制粒、干燥、整粒、总混、充填以及内包装、外包装等工序,除胶囊充填工序外,其余工艺过程管理与片剂基本一致,因此不再赘述。以下仅对胶囊充填工艺过程进行介绍。
胶囊剂充填:生产作业场所保持相对负压,粉尘由吸尘装置排除。室内应根据工艺要求控制温度和湿度。在充填前核对颗粒的品名、规格、批号、重量,并检查颗粒的外观质量和空胶壳规格、颜色应与工艺要求相符。生产前应试充填,确定合适的充填速度(该速度应在验证确认的范围内),并检查胶囊的装量、胶囊锁合、外观等,符合要求后才能正式充填,充填开始后应定时抽样检查胶囊装量和外观情况;
可选择安装金属探测器或采取其他有效的手段和方法,除去意外进入胶囊中的金属昇物。
已充填的胶囊,根据工艺特点,必要时应经过抛光和灯检,如果采用自动灯检设备,其效果应该经过确认。胶囊应盛于清洁的容器内,注明品名、规格、批号、重量等信息。
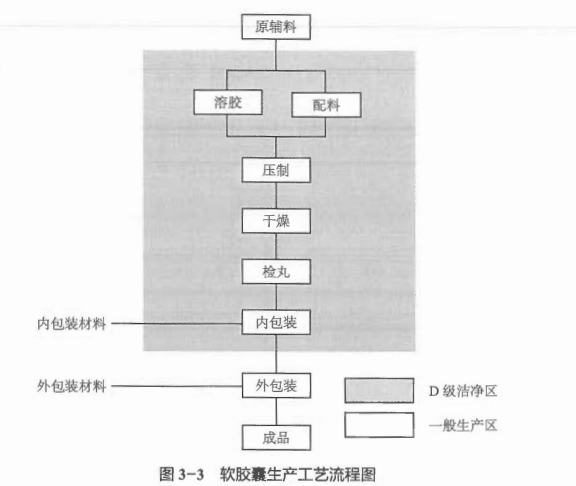
3.1.3 软胶囊的生产工艺流程
软胶囊剂生产工艺流程(图3-3)包括配制药液、溶胶、压丸、干燥、检丸、印字、内包装、外包装等步骤。
在长期储存中,酸性内容物也会对明胶水解造成泄漏,碱性液体能使囊壳溶解度降低。醛类药物会使明胶固化而影响溶出,应在内容物的配方时考虑。
在整个溶胶过程中严格控制溶胶温度和脱气泡时间,溶胶温度过高会破坏明胶的韧性,脱气泡时间过长导致胶液水分含量降低,胶液黏稠,不利于压制生产。
软胶囊压制生产时,应严格控制胶皮厚度、药液装量、设备转速、胶盒温度、喷体温度、冷水温度等参数。
软胶囊的干燥,是内容物、囊壳中的水分向环境迁移的过程,关键在于环境温湿度、干燥时间的控制。囊壳弹性除受明胶、增塑剂的种类、比例影晌外,囊壳的含水量也会影响软胶囊的弹性大小。
软胶囊压制成形后一般先进人预干转笼进行快速失水,使软胶囊迅速定形,然后再进人最终干燥。最终干燥根据产品特性,一般分为转笼干燥和托盘干燥:
转笼干燥为定形后的软胶囊在干燥转笼中送人低湿度的环境空气,继续失水干燥,达到所需的内容物或囊壳水分、胶囊硬度等相关指标要求。转笼干燥应注意转笼的转速和时间,因软胶囊在转笼中翻动摩擦,会影响胶囊的外观光亮。
托盘干燥为定形后的软胶囊均匀铺置于干燥托盘中,利用低湿度的流动或非流动的环境空气自然晾干至所需水分要求。在干燥过程中应注意分布于托盘的四周、中间、上下层位置的软胶囊,有可能因失水速度不同,造成软胶囊水分不均匀。
软胶囊的干燥过程应确认环境温度、湿度、时间等控制参数。
检丸分为尺寸筛选和外观检查:尺寸筛选一般通过多组高速转动的转辊对软胶囊直径进行筛选,每组转辊中两个转辊呈上窄下宽方式布置,通过对转辊间距的调整,将符合短径标准的软胶囊筛选出来,做为合格中间产品。将压制过程中产生的短径过长或过短的软胶囊、异型软胶囊做为不合格中间产品进行处理。外观检查一般人工目视检查或自动视觉拍照检查,将尺寸、畸形、空壳、异物等有缺陷的产品剔除。
印字常用的方式为字模印字、喷墨印字、激光刻字,应注意印字质量,确保胶囊印字清晰、完整。


