今天在waters网站浏览的,看到了关于CSA的一个白皮书。本来想顺藤摸瓜找到FDA的那个指南草案,结果没有。只能结合这个白皮书和ISPE的指南看看了,别说,里面介绍的知识感觉很不错,脉络分明,值得总结,于是,便总结一下吧。
对于waters相关仪器和软件的验证,建议咨询watrers400的在线专家。
本人仅仅是个人学习爱好做出推荐。
这个白皮书是公开资源,可以免费下载。链接如下:
https://www.waters.com/webassets/cms/library/docs/720007127zh.pdf
这个白皮书的作者Charlie Wakeham, 沃特世亚太大区 GxP合规经理,GAMP全球指导委员会秘书,《ISPE GAMP RDI良好规范指南:数据完整性源于设计》的联合发起人和丛集著者。她和印度的那个Anubha Mukherjee有一期线上讨论也不错,可以在bilibili找到。这两个人都是《ISPE GPG 数据完整性源于设计》的核心团队成员。
白皮书中介绍了法规的关注从CSV(ComputerizedSystems Validation)发展到CSA(ComputerSoftware Assurance)的脉络。具体如下:
■ 1985-1987:患者因计算机化系统在控制Therac 25放射治疗设备时发生错误而死亡
■ 1988:控制血库的数据管理软件出错可能导致血液存在受AIDS病毒污染的问题
■ 1991:在对多个欧洲生产基地的检查过程中发现计算机系统不合规, FDA据此禁止了对其产品的进口
■ 1992:第二版EUGMP指南中新增关于计算机化系统的附录11
■ 1995:发布《关于验证制药生产自动化系统的供应商指南》("GAMP1” )
■ 1996:发布《关于验证制药生产自动化系统的供应商指南》(“GAMP 2” )
■ 1997:发布21 CFRPart 11
■ 1998:发布《关于验证制药生产自动化系统的指南》( "GAMP 3 " )
2000年之后可以参考的故事,可以在《Validationof Chromatography Data Systems Ensuring Data Integrity,Meeting Business andRegulatory Requirements》(2Ed,R.D. McDowall)的书中找到更多例证,拽出这本书的一个图,附上以飨读者。
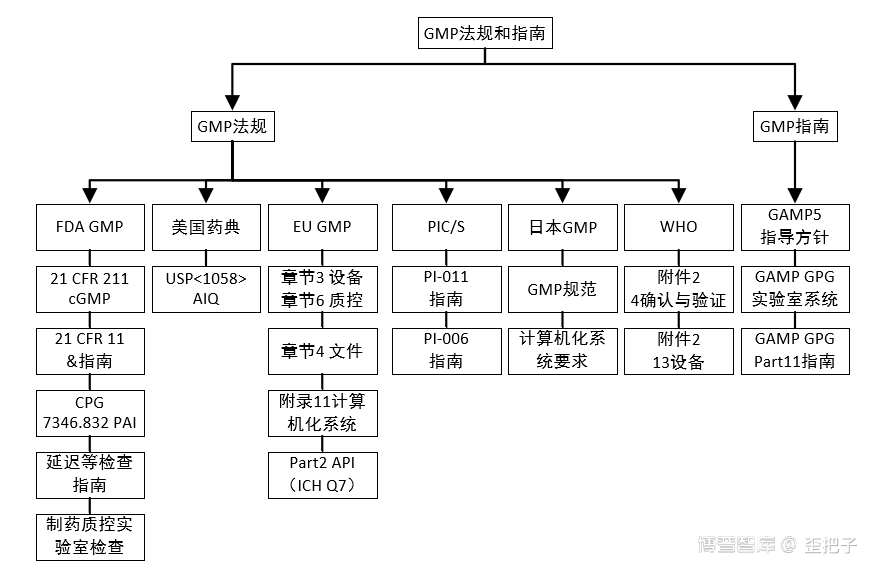
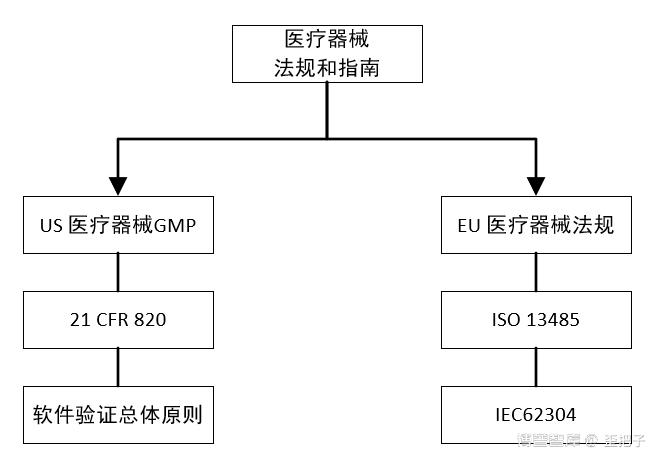
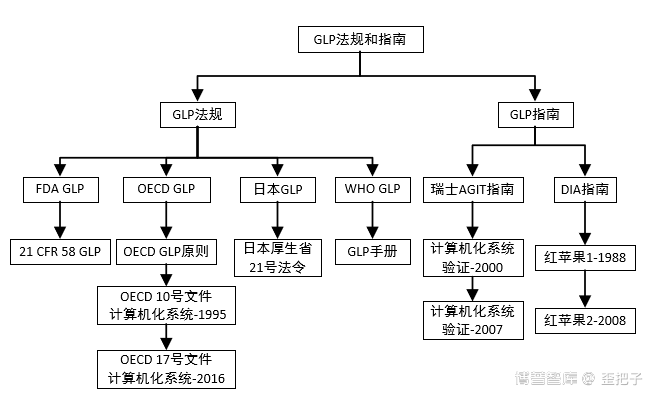
其它可参考的学习资料还有:PDA TR 31、TR 32,EDQM的几个附件,必然的还有GAMP 5。当然,若是关联到数据完整性这个大猪蹄子,那需要的知识就更多了,不打字了,截个图,这些资源博普智库都有。
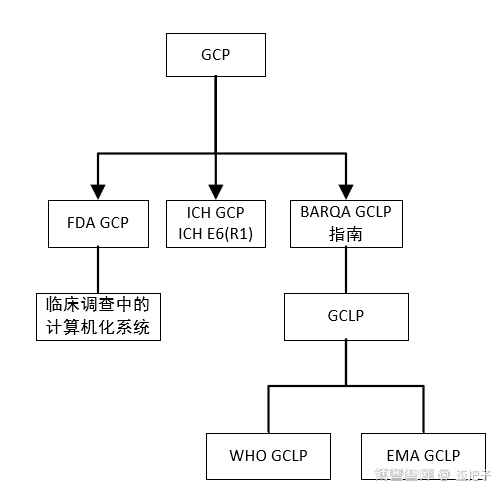
当然,白皮书的作者介绍了GAMP 5 的诞生过程以及一些错误的实践,部分内容摘录如下:
“大约在GAMP4发布的同时,US FDA开始构建“在检查时应用更多基于风险的方法”思维,该思维曾在2002年发布的文件"21世纪现行药品良好生产规范(CGMP)” 中提出,并在2004年的最终报告“ 21世纪药品CGMP-基于风险的方法”中正式通过。
GAMP5 (ISPE, 2008)的制定是为响应该FDA提案,针对如何将基于风险的方法应用于CSV给出实用性指导。GAMP 5中删除了软件分类2 (固件),但保留了其他分类,原因是行业内许多公司均已根据该分类制定其CSV策略。
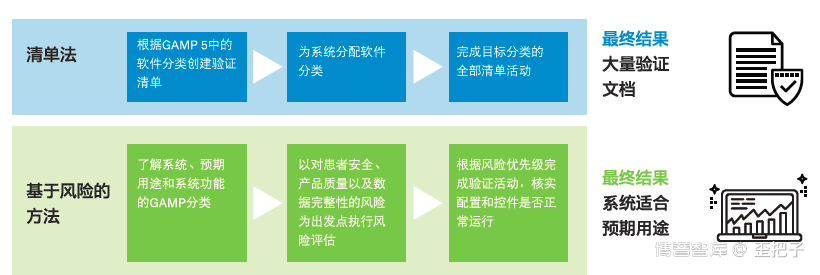
基于风险的方法中固定分类的存在似乎是GAMP 5的内部矛盾。基于风险的方法是风险与控制和验证策略(与风险评估结果相称)的连续集合。而GAMP分类会带动“孤岛思维”,许多CSV工作人员也确实犯过这样的错误。尽管GAMP 5提供了可能与特定软件分类相关的活动示例,但此类示例的目的绝不是用作合规检查清单。图1比较了清单法与基于风险的方法,并展示了各方法最终获得的结果。
应始终将“确保系统适合预期用途并保障患者安全、产品质量和数据完整性”作为验证目的。GAMP分类非常适合帮助您掌握所用系统功能的配置或自定义程度(会影响系统相关风险)
在白皮书中作者概述了在CSV实施中清单法与基于风险的方法的比较。相信,清单法更能贴合知识的实践和加速CSV的效率,毕竟后者更适合于软件的设计者。附图如下。
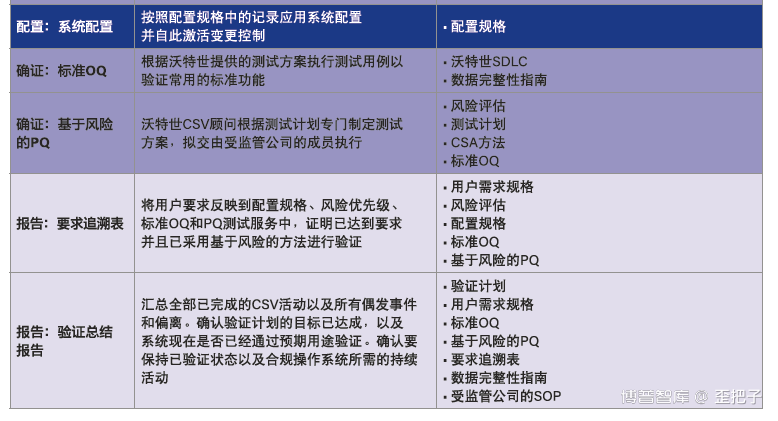
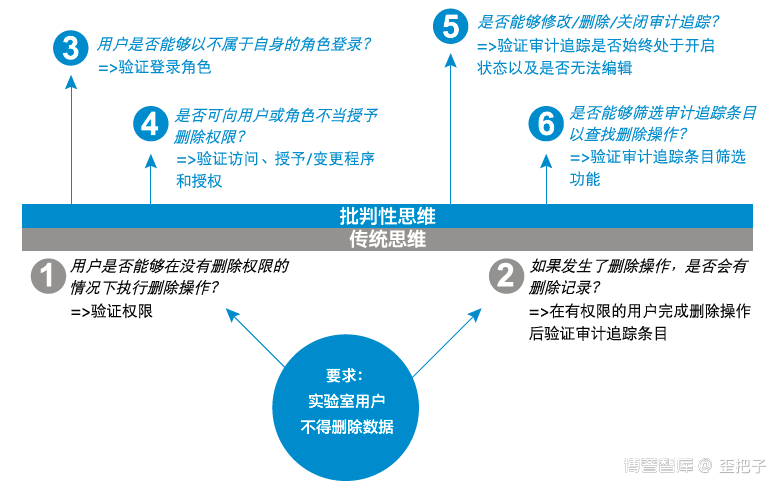
同时,作者分享了基于辩证思维的CSV测试计划,这个比笔者目前的实践要顺溜的多,这个是以业务流程的角度以实验室的思维来实施CSV,而不是IT的角度。如图:
之后作者介绍了FDA推迟了CSA的情况,以及CSA团队的文件成果被收入《ISPE GPG 数据完整性源于设计》附录19的过程。部分摘录如下:
“向计算机软件保障(CSA)迈进
在本白皮书发布时,美国FDA又推迟了其计算机软件保障(CSA)指南草案的发布。不过,ISPEGAMP发布了新的< GAMP RDI良好规范指南:数据完整性源于设计(ISPE 2020)》,其中包括一份由FDA行业CSA团队(FICSA)编写的详细附录。该GAMP指南附录是关于CSA在受监管环境下实际应用的首份正式指南。
辨证思维是CSA的固有思维;作为CSA和FDA “质量主张(Casefor Q uality)"提案的组成部分,辨证思维是FDA所提倡的以患者安全为中心的基础。辨证思维应运用于以下场景:初始项目规划、需求定义、风险评估、测试规划以及确证阶段的脚本编写、执行和报告。辨证思维需要透过表相客观地评估导致失效的潜在根本原因并开发用例,以及将技术和知识有效用于提升系统安装和运行质量。
虽然网上论坛将CSA称为计算机化系统验证的新方向,但实际上CSA只是基于风险的方法的下一步。为与GAMP保持一致,CSA根据对患者安全、产品质量和数据完整性的潜在风险运用质量风险管理原则。该方法有利于运用基于风险的方法确定测试的范围和严谨性,还可以确定测试所需文档量”
作者指出:
■组织注重质量文化和出色运营
■了解相关业务流程、系统如何支持该流程以及相应的
■受监管数据生命周期
■知晓GxP法规和数据完整性指南
■由经验丰富的CSV工作人员在CSV项目的各个阶段运用辨证思维执行验证
■ 专业、细致的系统技术知识
■真正希望系统能够保护患者安全、产品质量和数据完整性
最后,截图“了解CSV活动的目标和影响因素”作为结束吧,因为我迫不及待的要去认真看一下《ISPE GPG 数据完整性源于设计》附录19。
因为,我喜欢那里面的“布鲁姆认知分类金字塔”。