[摘要]目前,业界对数据完整性有了较深入的理解并根据国内和国际监管规则进行实践,随着我国加入ICH并启动了PIC/S的预加入申请,为确保企业的竞争力,数据治理势必成为主题领域。作者就当下的监管规则进行梳理,整理了为确保数据完整性的数据治理要素,并对质量控制实验室相关的要素进行解析、对数据治理的部分要素提供治理策略,从而,为数据治理在实验室的实践提供了例证路径。同时,参考相关专著和文献,对当下实验室的科学数据管理系统(SDSM)、实验室管理系统(LSM)和分析数据格式的统一化进程进行展望,为业内和仪器/设备的软件设计者提供了前沿思考。
[关键词]数据完整性、数据治理、混合系统数据
A review of data integrity and data governance indrug quality control laboratories
Abstract:
Keywords:dataintegrity,data governance,data generated by hybridsystem
一、引言
2016年1月26日,习总书记批示:把最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责落到实处,确保人民群众用药安全、有效[1]。在越来越多的国内和国际的药品合规检查过程中,数据完整性(Data Integrity,简称DI)和数据治理(Data Governance,简称DG)成为了高频词汇,相关公告、警告信等具体案例更是成为业内讨论的焦点。随着《药品管理法》和相关实施条例的出台,为了确保人民群众用药安全,结合实际国情,国家药监局公告了《药品记录与数据管理要求(试行)》,该“要求”于2020年12月1日起施行[2]。于2021年3月1日开始实施的新版《中华人民共和国刑法修正案(十一)》也警示着从业者:对数据的安全、准确、可靠不可等闲视之[3]。
笔者试图通过对数据完整性(简称DI)和数据治理(简称DG)领域相关法规的梳理,结合目前该领域相关工作的进展,对DI&DG进行进行一些思考;从而,希望能够帮助更好的理解和执行《药品记录与数据管理要求(试行)》,确保受监管实验室的数据可靠性,提振监管当局和从业者的信心。
二、背景
DI&DG问题的爆发并非首现于制药行业。最早追溯到1992年,美国环境保护局发布了《良好自动化实验室规范(GALP)》(征求意见稿)并于1995年施行其正式版[4],美国环保领域由此发现相关DI失败事件。药品领域的故事开始于1993年Barr实验室的法庭案件和判决[5-7],然后因2005年的Able实验室欺诈案而显见[8]。后一宗案件促使FDA将审查重点从纸质记录转向电子记录。因此他们发现了世界各地企业中更多数据造假和数据管理不善的案例。于是盖子揭开,世界范围的各国监管当局开始对DI相关问题进行研究并制定监管规则。
三、实验室数据完整性监管规则概览
对于实验室DI,就国内受监管符合性而言,主要的技术规范有:《药品生产质量管理规范(2010年修订)》(GMP)[9],GMP附录《计算机化系统》、《确认与验证》[10]、《药品记录与数据管理要求(试行)》[2]。
对于该领域,国际上各官方和学术团体出台了密集的指南,监管机构对数据完整性的关注从制药业这个最接近患者的部分扩大到GLP和GCP规范,并逐渐完善。各监管机构并未就数据完整性这一主题更新法规,而是发布了新的指导原则,如图所示。
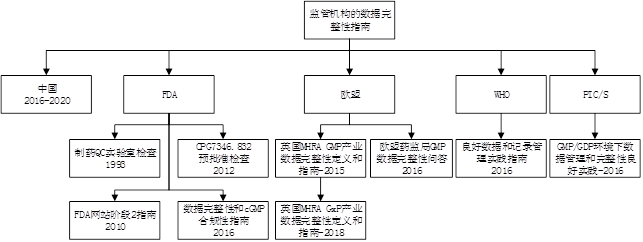
注:此图引自《DataIntegrity and Data Governance,Practical Implementationin Regulated Laboratories》。
此外,对于实验室DI&DG,可参考的专业书籍有《Validation ofChromatography Data Systems Ensuring Data Integrity,Meeting Business andRegulatory Requirements》(第二版,2018年)、《Data Integrity and Data Governance,PracticalImplementation in Regulated Laboratories》(2019年版)。两本专著的作者均为英国皇家化学会的R. D. McDowall先生。
四、质量控制实验室数据类型
根据《药品记录与数据管理要求(试行)》,数据、原始数据、元数据的相关定义为:数据是指在药品研制、生产、经营、使用活动中产生的反映活动执行情况的信息,包括:文字、数值、符号、影像、音频、图片、图谱、条码等;记录是指在上述活动中通过一个或多个数据记载形成的,反映相关活动执行过程与结果的凭证。原始数据是指指初次或源头采集的、未经处理的数据。元数据是用来定义和描述数据的数据,通过定义和描述数据,可以支持对其所描述的数据对象的定位、查询、交换、追踪、访问控制、评价和保存等诸多管理工作[2]。
对于实验室的数据,按其产生、使用、销毁的生命周期以及数据类型,可分类为:数量相关数据、时间相关数据、分析数据。对于分析数据,还可细分为观察数据、混合系统数据、计算机化系统数据。
在受管制的研发或质量控制实验室中,有几种分析是手工进行的,测试/检验结果是通过观察记录的,《Data Integrity and DataGovernance,Practical Implementation in RegulatedLaboratories》第10.5节举例有:外观、色彩、气味[11]。此外,对于多数生物实验室而言,培养基制备、实验记录、菌落计数等大量工作也是手工观察和手动记录的。混合系统是指以原始电子记录和纸张记录的组合为使用方式的计算机化系统,其记录也包括应审查和保留的总记录集[12]。当使用混合系统时,实验室分析人员使用计算机化的仪器系统创建原始电子记录,然后打印结果的摘要。这种混合系统的工作方法要求在整个记录保留期间,所有记录类型(包括纸质和电子)之间有一个安全链接。在使用此方法的环境下,对可能打印的电子文件(如模板、表单和主文件)的适当控制,应该是可用的。计算机化系统数据则是由一系列计算机硬件和相应软件组成,以满足特定的功能[10]。
对于数据的载体——记录,基于数据可被再编辑的能力,记录还可分为静态记录、动态记录,见下。
FDA、MHRA 和世卫组织的数据完整性指南的记录分类
记录类型 定义 动态记录 动态格式的记录,如电子记录,允许用户和记录内容之间的交互关系。例如,数据库格式的电子记录允许用户跟踪、趋势和查询数据;以电子记录形式保存的色谱记录允许用户(具有适当的访问权限)对数据进行再处理,并放大基线以更清楚地查看积分。[13,12] 动态记录是指记录格式允许用户与记录内容进行交互。例如,动态色谱记录允许用户更改基线并对色谱数据进行再处理,以使产生的峰看起来更小或更大。它还允许用户修改用于计算测试结果或其他信息(如计算收益率)的电子表格中的公式或条目。[14] 最初在动态状态下捕获的信息应该在该状态下保持可用性。[13]
对于GxP环境,可参考的数据治理定义有:无论数据以何种格式生成,都要记录、处理、保留和使用的一种安排,以确保在整个数据生命周期内记录完好[13]。无论数据以何种格式生成,都要记录、处理、保留和使用数据,以确保在整个数据生命周期内记录完整、一致和准确的安排的总和[12]。为确保在整个数据生命周期内,不论数据以何种形式产生,都能被记录、处理、保留和使用,以确保记录完整、一致和准确而作出的全部安排[15]。
研发和生产等受监管实验室都需要具备代表性的样本,然后获取和处理可靠的数据,以产生可靠的信息、知识和报告,以便高级管理层及时作出决策[16]。当然,这将涉及使用各种数据储存介质的被管制活动的文件证据。在实施和验证记录、数据的适当技术控制之前,第一次实施前就要规划好,这比实施后或监管缺陷后的修修补补要有价值得多。同样的,在使用实验室计算机化系统时,遵守规定的成本永远比不遵守规定的成本便宜[17]。
从GLP领域的经验来看,企业要么在监管启动推动其采取纠正措施时再次获得资金,要么就主动改进。可以看出是业务需求拉动数据治理,从而推动数据完整性,而不是法规推动。
五、实验室数据治理策略
1.数据治理的目标是确保数据完整性。基于上图的监管规则,可以整理出需要进行数据治理管理的7项要素,具体如下:
1.1数据完整性的领导层作用
在监管规则中,对质量和GMP的符合性,高层管理人员负全责。对数据治理和数据完整性规划的领导是必须的,这包括使数据完整性成为每个工作人员的一部分业绩目标的沟通程序。还应生成监控数据完整性计划执行情况的质量度量标准,并被输入到该计划的定期管理评审中。
1.2政策、规程和有效的培训
必须遵循确保所有活动的数据完整性的相应政策和规程,并对所有员工进行这些规程的培训。数据完整性必须包括在正在进行的GMP培训的监管要求中,以加强这一主题。员工必须理解数据完整性的重要性,并签署一份生成可靠数据的承诺或通过考核被认可。
1.3数据完整性的角色和职责
数据完整性的主要角色之一是数据所有者,MHRA、PIC/S和WHO的指南说明了这一点。实验室中每个系统或过程的现有过程所有者还应该对其过程/系统中生成和管理的数据的完整性负责,并且应该被指定为数据所有者,而不是创建另一个角色,可能重复一些职责。经过培训的用户必须正确地执行工作,然后是有效的第二人审查。最后,所有记录(纸质的和电子的)都应该随时可供审计和检查。
1.4工作环境/企业文化
这是高级管理层的最重要领域。我们需要的是建立和维护一种开放的文化,其中包括建立一种无责任的文化,使员工能够提出数据完整性问题。这种文化的一部分是员工能够提出数据完整性问题,而不用担心因为向质量保证报告而受到惩罚。就像异常结果的原因一样,错误应该被视为改善的机会,而不是隐藏在阴影里。此外,管理层不应对员工施加过度的压力去强制要求他们执行某些工作,因为这可能会造成数据的质量降低和数据的完整性问题。创建和维护正确的工作环境和文化是数据治理中最困难和最具挑战性的方面。
1.5规程和系统的评估
每个规程(具体指管理规程-SMP和操作规程-SOP)和系统都需要对数据完整性问题进行正式评估。所产生的记录、它们的关键性以及它们的脆弱性将与短期补救计划和长期解决方案一起记录下来。这些计划应该确定(如果有的话)需要额外的控制来确保数据完整性。一旦补救,就应进行监测,以确保这些计划发挥作用。
1.6外包工作
如果考虑将实验室工作外包给CRO或CMO,对供应商的数据治理和数据完整性控制进行评估是至关重要的。角色、责任、对代表发包人/赞助商产生的纸质和电子记录的访问、审核和沟通的权利必须包含在两个组织之间的技术或质量协议中。
1.7质量监督
包括对涉及数据完整性的法规和指导文件的解释、日常分析工作的监督、数据完整性审计的计划和执行以及数据完整性调查。从最后两项,可能有CAPA计划,以确保过程和系统是符合的。
概括起来,实施数据治理的路径可由下图演示:
2.数据治理的策略
对于数据治理,可将质量控制实验室分为新建和既有实验室两种情形。通过研究上述路径图,无论哪种类型的实验室,管理层资源、企业文化的支持都是必不可少的。此外,为确保数据治理的有效实施,必要且有效的培训、明确的角色职责分配、完善的管理和操作规程及其评审回顾和更新等文件要素、质量保证的监督、审计和调查等,均是数据治理的必须路径。下文仅就部分要素展开讨论。
2.1角色和职责
完备的角色和明确的职责可确保数据治理工作的有的放矢。具体个人不应承担过多的角色,具体而言主要的角色和职责有:
2.1.1高级管理层
领导数据治理和数据完整性;制定数据治理战略;参加公司数据完整性委员会会议;设置数据完整性文化。
2.1.2企业数据完整性项目组
批准新项目;审查现有项目;资源和预算;实施现场巡查解决问题;倡导数据完整性文化。
2.1.3数据所有者
了解法规和合规要求;建立数据完整性和数据质量要求,如准确性、质量、完整性;定义数据生成的访问和安全性;定义数据备份/恢复和归档/还原;批准所有影响数据采集、处理、质量和完整性的事项;定义和审查监控指标。
2.1.4数据管理员
实现任何数据治理/完整性要求;确保数据所有者对系统的要求得到遵守;向数据所有者提出改进或变更建议以供审核;收集和整理数据,供数据所有者审核;协助QA审核和监管检查。
2.1.5 IT主题专家
实现数据所有者对IT支持的要求;确保数据所有者对系统的要求得到遵守;控制对系统的更改;收集和整理数据,供数据所有者审核;协助QA审核和监管检查。
2.1.6质量保证人员
检查、监督数据治理政策的实施;监督数据的采集、记录、使用等流程和规程的合规性;确保质量管理体系数据完整性要素的合规实施;组织并参与数据治理相关内部审计及监督和沟通相关纠正和预防措施的落实。
2.2培训和考核
由于行业中糟糕的数据管理实践或数据造假,监管机构检查员现在已经接受了关于检测数据完整性违规行为的培训。制药行业需要做出反应,这种反应不能是表面文章,而应是通过在整个组织中确定有效的数据完整性政策和规程;从整体的数据完整性政策,基于纸张的,混合系统的和计算机化系统的良好的文档实践;以及如何解读实验室数据来实现。与政策和规程相结合的,必须有有效的员工培训,并在必要时提供培训有效性的证据。对于培训考核这个领域,2003年,美国国家环境实验室认可协会(NELAC)制定了实验室认可标准[18],包括实验室数据完整性培训的具体要求;该标准正在被TNI正在开发的公共标准所取代。对于这个关于数据完整性培训的讨论,2003年的标准对于我们是适合的,因为它包含了与数据治理、数据完整性、特别是数据完整性培训相关的需求。出于这个原因,它将帮助受监管的GxP组织和实验室理解数据完整性培训的要求,并且可以根据自己的使用需求调整方法。该标准的摘要信息如下表:
NELAC对数据完整性的主要要求的摘要
章节号 摘要 5.4.15 •数据完整性审查是内部审计的一部分,以评估不适当行为的证据 •问题的处理将保密,直到调查或其他适当的行动完成和问题澄清 •调查发现的不适当行为,包括任何纪律处分,纠正措施和所有适当的客户通知 •所有文件将至少保存五年 5.4.2.6.1 •管理层将提供保密的数据完整性报告机制 •这将确保保密性,并为提出道德方面问题提供一个相对隐私的环境 5.5.4.1.1 •建立和维护准确反映当前实验室活动所有阶段的规程,包括评估数据完整性的方法 5.5.2.7 •新入职员工将接受数据完整性培训,并每年对所有现有员工进行培训 •培训必须包括组织使命、在所有分析报告中诚实和全面披露的关键要求,以及如何和何时报告数据完整性问题和记录保存 •培训将包括讨论所有数据完整性标准操作规程和培训文件,包括如何记录分析记录 •员工必须明白,如果不遵守实验室数据规程,将导致详细的调查,并可能导致非常严重的后果 •所有培训材料的复印件将发给每位学员 •所有的数据完整性培训都将有签字的考勤表或等效记录 •与会者必须证明他们理解与数据完整性相关的义务 •高级管理人员积极支持和实施数据完整性规程 •应讨论违反行为准则的具体例子,包括不当的数据操作、仪器时钟的调整和标准浓度的不当改变 •数据完整性培训要求强调正确记录数据的重要性,包括不良记录和可接受记录的例子 •应向员工提供有关外部职业道德培训和其他外部资源的信息
数据完整性策略的培训是一个非常重要的主题,不能让员工呆在房间的角落里阅读和理解文档。这将导致对文件意图的误解和多种解释。相反,为了确保对政策的一致理解和应用,面对面或教师领导的培训是数据完整性培训的首选选项。然而,较大的机构或组织会采用电脑培训。无论采用何种方式,该培训必须由高级管理人员引入,以重申公司对数据完整性的承诺。
最重要的是,在培训之后,必须有一种手段来证明自己的能力和对政策的理解。这样做的理由是基于NELAC标准[18]的这种需要证明员工理解的证据,如果他们违反了数据完整性,员工将签署一份表格,说明他们的理解和他们的行为的后果。如果个人违反了规定,他们可以声称他们不了解数据完整性策略。然而,如果有证据表明在培训后他们成功地完成了理解评估,那么就没有机会以此为借口。
培训可以通过开卷问卷或计算机测试来完成。由于这是整个数据完整性计划的关键组成部分,如果采用开卷考试,考试的及格分数必须为100%。如果参与者没有达到这个标准,那么他们必须参加另一个培训课程和评估。相反,如果使用闭卷考试,那么通过分数可以降低到80-85%,因为考试必须通过记忆来完成。一般而言,开卷考试更好,因为它鼓励学员在回答问题前阅读政策、培训材料和他们的笔记。
诚如《Data Integrity and Data Governance,PracticalImplementation in Regulated Laboratories》7.12.2章节所述,应特别注意的是:没有开放的文化,培训毫无价值。尽管我们花了很多时间介绍和讨论GxP规则和数据完整性的各个方面的培训,但如果组织或管理的压力破坏了培训成果,那冠冕堂皇的培训是没有价值的[11]。
2.3管理和操作规程
简而言之,数据分为:观察数据-纸质数据、混合系统数据、计算机化系统数据。就合规性而言,后者强于前者。因而受控实验室需要对上述数据建立相应的管理和操作规程。对于纸质数据,本节指实验室数量流、时间流中用纸质记录记载的信息数据和全部观察测试的过程、结果。故而是指全部观察数据和部分混合系统的数据。
2.3.1纸质记录/数据的管理
对于纸质记录/数据,必须明确相应的基准,较好的参考是纸质记录的良好文档实践(GDocP)[12]。整理相关要素如下:
GDocP要素 良好的文档实践期望 记录的格式 •仅使用经授权的打印媒体记录数据,例如:受控的空白表格 •确保页码的格式,如X/Y •多页必须装订牢固,以防止移除、复印和更换 •适当时定期检查和修改 禁止的行为 •不可使用铅笔和可擦除笔 •绝不能使用修正液或涂改液 •不要使用同上、同上操作——每次观察都必须记录 •空格不应留空。 •不应使用日期印戳(根据检查人员的情况,日期戳可能被接受,也可能不被接受) •其他员工不能代表他人签名或“pp”签名 译者:PP是拉丁语短语“per procurationem”的缩写,意思是您代表另一方签署信件或其他文件。 •签名绝不能伪造 •永远不要覆盖条目 •不要通过复制页面的方式来掩盖重做的工作 •禁止使用未经授权的媒体记录GXP数据,如废纸 •对条目进行更改时,避免使用符号链接到其它注释, •永远不要写回忆录或提前日期记录
鉴于纸质记录较差的可控性,应在文化、管理等层面明确“乌龙指、伪造和欺诈”等失败类型[11],以鼓励员工报告此类偏差。
乌龙指:分析师在进行测试时无意中犯的错误,它既可能在纸上也可能在电子设备上产生。比如员工手指粗,键盘输入批号时连键。
伪造:为了欺骗而故意写入或输入数据或结果的个例。
欺诈:以欺骗为目的,两个或两个以上的个人之间串通,故意写入或输入数据或结果。
伪造是一个人做的,而欺诈是两个或两个以上的人做的;然而,两者的影响是一样的:欺骗的意图。三者的危害程度、处理方式显然是不同的,尤其是后两者。
2.3.2混合系统的问题
随着监管方的“努力”,一些老旧系统和设备无法满足数据完整性的全部要求,企业不得不采用增加纸质记录的方式弥补计算机化的缺陷,从而产生了混合系统。在实践中,相对纸质系统和计算机化系统来说,混合系统的高风险愈发清晰,那么如何识别和控制这些风险就变得迫切起来[19]。
对于混合系统,《Data Integrity and Data Governance,PracticalImplementation in Regulated Laboratories》给出如下观点和可行的风险防控措施[11]:
大多数打印纸张的混合系统似乎已经过时了。此外,通常每一页都必须由测试人员和审核人员进行签名,这是一项容易出错且乏味的任务。打印输出还必须与分析中创建或使用的电子记录进行核对。
根据世卫组织《数据完整性指南》附录1中混合系统的概述,有一种简单的方法可以减少打印的纸张数量。如下图所示,这是一个受控的审核表单,用于在使用混合系统进行分析期间创建的记录的创建和审核。该表与实验室记录审核的分析规程和审核SOP相关联。
在分析开始的时候,表单的唯一编号版本被发送给测试人员,测试人员记录分析的开始和结束的数据和时间(以帮助审核人员搜索审计跟踪条目),以及记录创建、修改的记录和它们存储的位置。唯一的打印输出是可报告结果和分析信息的测试摘要。测试结果打印和审核表由测试人员签字。当记录准备好进行审核时,第二个分析师在屏幕上审核电子文件,没有打印输出,这使任务更简单和更快。审核员检查由测试执行者生成的数据文件和上下文元数据文件,并将它们记录在审核表单上。适用的审计跟踪条目也要审核并形成文件。表格中包括数据是否伪造的检查,因为这将在数据完整性审计和(如适用)数据完整性调查期间进行检查。如果需要进行更改,则将这些更改记录在案,并发送回测试人员以进行更新。审核完成后,审核者在表单上签字。如果实验室规程需要,表格上可能有空白的地方供批准或QA签字。
当然,混合系统——用签名纸打印出电子记录的计算机系统——可能是最糟糕的实践。实验室必须管理两种不兼容的媒体格式:纸质和电子记录。最好的建议是:为确保法规遵从性和业务效率,通过使用电子系统来消除这些混合系统。是的,这需要资源投入,并且要考虑现有设备/仪器的剩余价值,这可能是个长期的过程。但是,高级管理层应该有决心在未来实施这一改变。
当然,当下一部分混合系统可通过一定联合措施实现合规运行,如具备用户分级、数据可归属的很多光谱软件,仅需要对计算机系统进行配置,防止时间串改、数据删除并实现自动异地备份、数据版本识别和报警即可。为提高实验室效率、周转率,并尽可能的减少人为干预;并且,随着仪器厂商在光谱仪器的网络版软件及LMS方面的努力,这类软件的Bug会逐件降低到可承受的程度。
2.3.3计算机化系统
在考虑电子系统的记录/数据时,以下几个假设应该成立:
A.实验室计算机化系统经过验证,适合预期用途。
B.应用程序被配置为保护电子记录,且是有文档记录的、配置的应用程序实例验证。
C.有一个符合技术要求的正确运行的审计追踪[10,20]。
D.对操作系统、数据目录、系统时钟和回收站的访问仅限于授权人员。
E.应用程序内部的工作流应被配置为强制遵守和符合数据完整性。
针对受监管的GxP系统,电子系统的良好文档规范可归结为:
GDocP要素 良好的文档实践期望 访问控制 •每个系统都有定义并记录的用户类型和访问权限 •更大的系统将有用户组来区分所执行的工作,如分析开发和QC或方法开发和常规分析 记录格式 •由计算机化系统定义 •可以通过校验和或其他方式保护记录,以阻止对记录的更改 •数据库,例如光谱,必须在程序和/或变更控制下进行控制和维护 创建和储存记录 •当记录被创建时,它们必须被存储在媒体上——在内存中操作记录而不保存是不允许的[20]。但整个体系必须支持这一功能 • 记录应该由系统使用用户定义的方案自动编号,以防止“试针”和准备非正式测试 •记录应该存储在设计良好的数据库中,而不是存储在用户可以访问的目录中 •数据存储位置应该是安全的和有弹性的网络存储设备 •如果有技术控制能够实现,应该限制数据的存储位置 更正条目和审计跟踪 •数据修正只能通过应用程序进行 •在计算机生成的审计跟踪中捕获更改,该跟踪应识别作出更改的用户、旧值和新值以及更改的日期和时间 •审计跟踪必须是安全的,并且是可搜索的 •变更的理由应予以说明;这可以通过上下文敏感的预先定义的原因和/或自定义文本条目 备份和恢复 •必须对系统生成的记录进行定期备份 •备份的程度(完全备份、差异备份或增量备份)取决于每个系统产生的记录的临界性 •必须验证备份和恢复 •必须定期进行恢复测试,以确保可以恢复记录 •备份是灾难恢复和/或业务连续性计划的第一部分 系统架构 •系统必须确保在用户工作场所的可用性,以确保用户活动的同时记录 •系统的临界性将决定操作和记录存储所需的硬件弹性 •与可信时间源链接的安全时间和日期戳 •在适当的情况下,在应用程序上实现时区识别 •必须保证所产生记录的存储和保护 •独立工作站缺乏弹性,会遭受键盘争用 •针对恶意软件和恶意攻击的硬件和软件的保护必须到位
此外,还应该考虑到仪器/设备日志的问题。数据完整性的基本文件之一是仪器日志,通常是装订和分页的纸质记录。从监管的角度来看,必须有一个使用仪器日志的规程和培训。
2.4质量保证监督
作为质量管理体系的关键要素,质量保证系统必须建立并完善针对质量控制系统的数据治理的相关监督管理和操作规程,并通过有效的培训得以落实。确保数据完整性的主要质控实验室和质量保证规程统计如下表:
实验室数据完整性规程 质量保证数据完整性规程 分析规程的开发、验证和性能监控 员工培训管理 仪器设置,例如色谱仪、光谱仪等。 偏差管理和CAPA行动 处理完整数据:纸张、混合系统和电子系统 提高合规性关注度 科学数据的解释 QA数据完整性调查 审核跟踪的审核 灾难恢复 超出标准结果(OOS)的调查 合同实验室协议的质量审计
2.5DI&DG实施注意事项
数据完整性领域的治理规划、策略应基于数据治理的风险评估,除参考文献2、9、10外,参考工具尚有PDA TR 80、PDA<Microbiological TestData--Assuring Data Integrity>,ISPE<Considerationsfor a Corporate Data Integrity Program>,PIC/S<GOODPRACTICES FOR DATA MANAGEMENT AND INTEGRITY IN REGULATED GMP/GDP ENVIRONMENTS>。另外,WHO于2021年3月25日发布《WHO技术报告No.1033附录4:数据完整性指南》[21],该指南取代了《Guidance on Good Data and Records Management Practices》(GDocP);PIC/S的《受监管GMP/GDP环境下数据管理和完整性优良规范》2016年版草案[15]已经于2021年7月1日更新发布为正式版本,业内从业者实际应用时应参考当相关指南的当前有效版本。
对于计算机化系统,比较实用、全面的风险评估工具为国际药物开发创新与质量联盟(IQ)的数据完整性风险评估工具[22],若质量保证监督能够正确回答该工具中的60个问题,在很大程度上能够满足目前监管趋势,并保护相关各方利益;此外,此工具也可用于新引入系统时的评估。
六、数据治理展望
我国于2017年加入人用药品技术要求国际协调理事会(ICH),为全球新药申报与临床研发带来机遇与挑战[23];2021年9月29日,国家药品监督管理局发布工作动态信息,已经正式致函药品检查合作计划(PIC/S),申请启动预加入程序[24];为赢得全球竞争的机会,GxP领域的数据完整性和数据治理势必被更多的科研机构、生产企业和CRO、CMO、CDMO等所重视。企业也势必在数据治理领域加大投入,以确保数据完整性。同时,国内用于科研及质控的分析仪器控制软件的水平也参差不齐,为满足DI&DG要求,势必会进行新版本软件的开发、升级;这也要求上述企业掌握相应的计算机化系统验证(CSV)和基于生命周期的数据治理知识。
另外,商业的现成软件(Commercial off the shelf software)被用来完成药品相关数据的抓取、采集,此类软件并未采用GAMP的标准分类。尽管科学数据管理系统(SDMS)、实验室管理系统(LSM)能够通过网络抓取其它软件生成的数据或者从具备接口的仪器上采集数据[25],甚至可以转换为各供应商均可使用且符合国际化标准数据交换格式(包括IUPAC JCAMP-DX[26])的数据,但是尽管数据文件可以通过各种方式被另一个数据系统传输和读取,但是任何元数据不太可能被另一个色谱数据系统读取,因为这些文件没有通用的标准。
为了应对上述问题,基于可扩展标记语言(XML)的通用数据文件格式已经在分析实验室中得到了改进。另外一个分支是数据可以使用分析信息标记语言(AnIML)存储在文本文件中,而不是二进制文件中,其目标是允许同一分析技术的不同应用程序之间的数据可移植性。这个标准已经发展了十多年,而且,这些数据一旦被纳入仪器应用或添加到现有系统的转换软件中,它提供了比生成UV-Vis和色谱数据的现有系统更耐用的能力。与此同时,一个由制药公司组成的财团成立了Allotrope基金会,为主要分析技术的独立于供应商的数据标准的定义、开发和部署提供资金[27]。其目标是开发标准,以便在组织内部共享分析数据,而不需要使用原始的软件应用程序或硬件,因此更符合新数据标准的任何仪器应用程序都可以用于审查和重新评估数据。使用Allotrope框架开发的工具获取和存储的数据旨在促进法规提交的汇编和监管机构随后的审查。此外,这些涵盖数据文件和上下文元数据的标准将有助于在访问和检索旧数据时进行检查和审计。这将为制药公司和监管机构节省时间。
另外的一些与药品质量控制或合同实验室相关的领域有:
从企业战略角度看,基于“云上”的工作或管理模式(如SaaS-软件即服务),已经在制药行业广泛实践,《医药行业合规管理规范》等医药行业标准也在反腐、合规领域开始发力[28]。
从智能化系统的设计角度看,应用于流程工业中的批量控制系统的设计和规范(ISA-88)、企业系统与控制系统集成国际标准(ISA-95)标准集也应作为系统设计者和系统应用者关注和参考的指南。
七、总结
数据完整性和数据治理领域的经典学科——色谱科学,已经从拿着积分纸、直尺的时代进步到了智能化、网络化的信息联网抓取、自动进样、自主分析、自动报告、邮件预警的时代。随着认知加深和计算机及计算机语言、数据库的进步,数据传递和应用的合规化、智能化必将加速,这也也必将促进行业进步、解放分析科学家的双手。
另外,随着GLP相关机构对DI&DG深入研究[29]和经验传播,药品GMP、CMO、CDMO等机构和公司也可以借鉴相关经验来完善本领域的数据治理规划和策略。
限于篇幅原因,本文不做过多展开。专业人士可阅读文中推荐的专著和ISA相关标准集。

