
Hello, 大家周末愉快!小编今天与大家分享一下药物警戒的有关知识,因为小编个人认为,国内对于药物警戒的管理是相对薄弱的,药品的终端消费者,甚至批发,零售机构对于药物警戒的意识淡薄,患者服用药物产生了不良反应也不知道如何报告,向什么机构报告。美国FDA对于上市后药品安全,也就是药物警戒的管理是非常系统的。所以希望本文可以令制药行业从业者以及终端药品消费者可以更好地了解什么是药物警戒?什么是FDA要求提交的开发安全性更新报告(DSUR)和定期安全性更新报告(PSUR)。
药物警戒是指药物不良反应的检测、监测、评估和预防,贯穿药品生命周期的整个过程。安全信息会在定期的时间间隔内被收集和评估,并以安全更新报告的形式进行总结。安全更新报告对于保护患者健康、管理风险以及确保法规合规性至关重要。全球各地的监管机构要求制药公司在药品批准前和上市后监测过程中提交安全更新报告。遵守这些法规要求是获得和维持药品上市许可的必要条件。
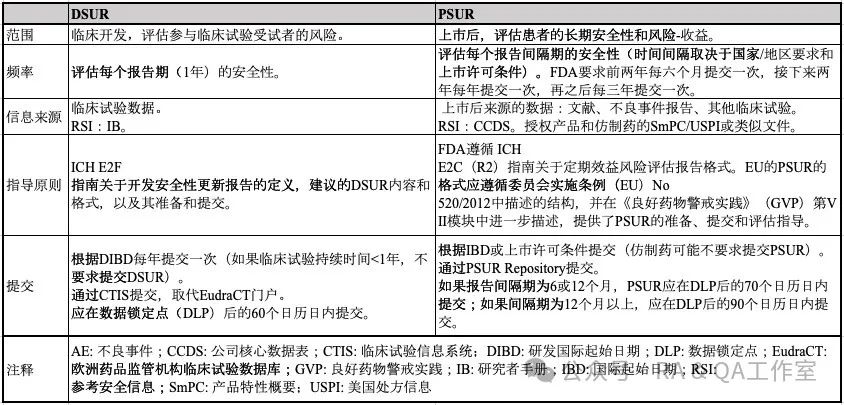
分别针对上市前安全性和上市后的安全性,FDA要求药品持有人提交DSUR和PSUR, 两者都是国际人用药品注册技术协调会(ICH)要求的法规文件,用于描述药品的安全特性和风险-收益情况。本文简单介绍DSUR和PSUR在内容、格式和提交方面的异同。
DSUR 包含关于处于临床研究阶段药物的安全信息,并定期更新正在进行的临床试验中获得的新安全信息。
PSUR 包含药品在获得上市许可后收集的安全信息。通过收集真实世界的安全信息来确定是否存在新的安全风险和/或药物的风险-收益比是否发生了变化,并采取措施来减轻安全问题并保护公众健康。(注:定期效益-风险评估报告 [PBRER] 与 PSUR 是相同的,根据各自监管机构的偏好使用不同的术语。)
DSUR的准备工作从任何国家批准的第一个干预性临床试验之日开始,该日期称为国际研发起始日期(DIBD)。这也是1年报告期的第一天。每个报告期的最后一天被称为数据锁定点。DSUR 每年更新一次,直到提交上市许可前最后一次临床试验的临床研究报告(CSR)。
PSUR的准备工作从任何国家的首次上市许可/批准之日开始,该日期称为国际起始日期(IBD)。PSUR 根据国家/地区的要求进行更新,如果药品是仿制药,可能有些国家不需要提交 PSUR。是否需要提交 PSUR 以及向监管机构提交报告的频率取决于国家或地区的法规要求,通常取决于批准日期、产品上市的时间长度以及对产品风险-收益特征的了解程度等因素。
下表对比了DSUR和PSUR的不同方面:
DSUR和PSUR都是药品制造商需要向FDA提交的定期安全报告;那么患者在使用药品的时候发生不良反应如何报告呢?患者可以向FDA或制造商报告不良事件,向FDA报告时,患者可以拨打1-800-FDA-1088或访问www.fda.gov/Safety/MedWatch,直接线上报告;向制造商报告的话,患者可以拨打药品说明书上制造商提供的电话号码,制造商有专门的药物警戒部门,负责登记和收集患者的不良反应,评估不良反应的严重程度,在不同的时间框内向FDA提交报告。
希望读完本文,制药行业的同仁可以更好地了解DSUR和PSUR,也同时提高普通读者、药品消费者对于药物警戒的意识。关于药物警戒,下篇接着讨论FDA有关药物不良反应的分类以及报告时限。
关注、转发、分享美漂小编的公众号,了解更多药品/器械注册知识~
💪🏻Make a difference in human health!
✉️药品/医疗器械咨询服务请后台留言



