欢迎访问『 博普智库 』制药人必备知识工具
1121 抑菌效力检查法
抑菌剂是指抑制微生物生长的化学物质。抑菌效力检查法系用于测定无菌及非无菌制剂的抑菌活性,用于指导药品研发阶段制剂中抑菌剂种类和浓度的确定。
如果药物本身不具有充分的抗菌效力,那么应根据制剂特性(如水溶性制剂)添加适宜的抑菌剂,以防止制剂在正常贮藏或使用过程中由于微生物污染和繁殖,使药物变质而对使用者造成危害,尤其是多剂量包装的制剂。
在药品生产过程中,抑菌剂不能用于替代药品生产的GMP管理,不能作为非无菌制剂降低微生物污染的唯一途径,也不能作为控制多剂量包装制剂灭菌前的生物负载的手段。所有抑菌剂都具有一定的毒性,制剂中抑菌剂的量应为最低有效量。同时,为保证用药安全,成品制剂中的抑菌剂有效浓度应低于对人体有害的浓度。
抑菌剂的抑菌效力在贮存过程中有可能因药物的成分或包装容器等因素影响而变化,因此,应验证成品制剂的抑菌效力在效期内不因贮藏条件而降低。
本试验方法和抑菌剂抑菌效力判断标准用于包装未启开的成品制剂。
培养基
培养基的制备
胰酪大豆胨液体培养基、胰酪大豆胨琼脂培养基、沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基照无菌检查法(通则1101)( (通则1101))制备。
(通则1101))制备。
培养基的适用性检查
抑菌效力测定用培养基包括商品化的预制培养基、由脱水培养基或按处方配制的培养基均应进行培养基的适用性检查。
菌种 试验所用的菌株传代次数不得超过5代(从菌种保藏中心获得的干燥菌种为第0代),并釆用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。培养基适用性检查的菌种及新鲜培养物的制备见表1。

注:*大肠埃希菌仅用于口服制剂的抑菌效力测定。
菌液制备 取金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、白色念珠菌的新鲜培养物,用pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的菌悬液。取黑曲霉的新鲜培养物加入适量含0.05%(ml/ml)聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液或含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱。然后,采用适宜方法吸出孢子悬液至无菌试管内,用含0.05%(ml/ml)聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液或含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液制成适宜浓度的孢子悬液。
菌液制备后若在室温下放置,应在2小时内使用;若保存在2~8℃,可在24小时内使用。黑曲霉的孢子悬液可保存在2~8℃,在验证过的贮存期内使用。
适用性检查 分别接种不大于100cfu的金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌的菌液至胰酪大豆胨琼脂培养基,每株试验菌平行制备2个平板,混匀,凝固,置30~35℃培养不超过3天,计数;分别接种不大于100cfu的白色念珠菌、黑曲霉的菌液至沙氏葡萄糖琼脂培养基,每株试验菌平行制备2个平板,混匀,凝固,置20~25℃培养不超过5天,计数;同时,用对应的对照培养基替代被检培养基进行上述试验。
结果判定 若被检培养基上的菌落平均数不小于对照培养基上菌落平均数的50%,且菌落形态大小与对照培养基上的菌落一致,判该培养基的适用性检查符合规定。
抑菌效力测定
菌种 抑菌效力测定用菌种见表1,若需要,制剂中常见的污染微生物也可作为试验菌株,例如含高浓度糖的口服制剂还应选用鲁氏酵母为试验菌株。
菌液制备 试验菌新鲜培养物制备见表1,铜绿假单胞菌、金黄色葡萄球菌、大肠埃希菌、白色念珠菌若为琼脂培养物,加入适量的0.9%无菌氯化钠溶液将琼脂表面的培养物洗脱,并将菌悬液移至无菌试管内,用0.9%无菌氯化钠溶液稀释并制成每1ml含菌数约为l08cfu的菌悬液;若为液体培养物,离心收集菌体,用0.9%无菌氯化钠溶液稀释并制成每1ml含菌数约为l08cfu的菌悬液。取黑曲霉的新鲜培养物加入适量含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱,然后,用适宜方法吸出孢子悬液至无菌试管内,加入适量的含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液制成每1ml含孢子数l08cfu的孢子悬液。测定1ml菌悬液中所含的菌数。
菌液制备后若在室温下放置,应在2小时内使用;若保存在2~8℃,可在24小时内使用。黑曲霉的孢子悬液可保存在2~8℃,在7天内使用。
供试品接种 抑菌效力可能受试验用容器特征的影响,如容器的材质、形状、体积及封口的方式等。因此,只要供试品每个包装容器的装量足够试验用,同时容器便于按无菌操作技术接入试验菌液、混合及取样等,一般应将试验菌直接接种于供试品原包装容器中进行试验。若因供试品的性状或每个容器装量等因素需将供试品转移至无菌容器时,该容器的材质不得影响供试品的特性(如吸附作用),特别应注意不得影响供试品的pH值,pH值对抑菌剂的活性影响很大。
取包装完整的供试品至少4份,直接接种试验菌,或取适量供试品分别转移至4个适宜的无菌容器中,若试验菌株数超过4株,应增加相应的供试品份数,每一容器接种一种试验菌,1g或1ml供试品中接菌量为105~106cfu,接种菌液的体积不得超过供试品体积的1%,充分混合,使供试品中的试验菌均匀分布,然后置20~25℃避光贮存。
存活菌数测定 根据产品类型,按表2-1、表2-2、表2-3规定的间隔时间,分别从上述每个容器中取供试品1ml(g),测定每份供试品中所含的菌数,测定细菌用胰酪大豆胨琼脂培养基,测定真菌用沙氏葡萄糖琼脂培养基。存活菌数测定方法及方法适用性试验照“非无菌产品微生物限度检查:微生物计数法(通则1105)”进行,方法适用性试验用菌株见表1,菌液制备同培养基适用性检查,方法适用性试验试验菌的回收率不得低于50%。
根据存活菌数测定结果,计算1ml (g)供试品各试验菌所加的菌数及各间隔时间的菌数,并换算成lg值。
结果判断 供试品抑菌效力评价标准见表2-1、表2-2、表2-3,表中的“减少的lg值”是指各间隔时间测定的菌数lg值与1ml(g)供试品中接种的菌数lg值的相差值。表中“A”是指应达到的抑菌效力标准,特殊情况下,如抑菌剂可能增加不良反应的风险,则至少应达到“B”的抑菌效力标准。
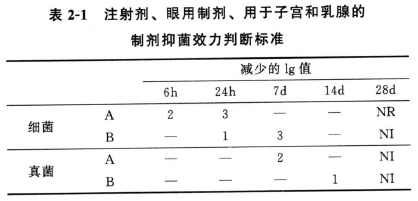
注:NR试验菌未恢复生长。
NI未增加,是指对前一个测定时间,试验菌增加的数量不超过0.5 lg。

注:NI未增加,是指对前一个测定时间,试验菌增加的数量不超过0.5 lg。

注:NI未增加,是指对前一个测定时间,试验菌增加的数量不超过0.5 lg。
继续阅读
在线查询结果来源于2020年版中国药典,仅供参考。由专业团队进行审核校对。

