欢迎访问『 博普智库 』制药人必备知识工具
利福平胶囊
本品含利福平(C43H58N4O12)应为标示量的90.0%~110.0%。
【鉴别】(1)取本品的内容物适量,加甲醇溶解并稀释制成每1ml中约含利福平10mg的溶液,滤过,取续滤液,照利福平项下的鉴别(2)试验,显相同的结果。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
以上(1)、(2)两项可选做一项。
【检查】有关物质 照高效液相色谱法(通则0512)( (通则0512))测定。临用新制或存放于2~8℃条件下6小时内使用。
(通则0512))测定。临用新制或存放于2~8℃条件下6小时内使用。
供试品溶液 取装量差异项下的内容物适量(约相当于利福平0.1g),精密称定,加少量乙腈(约利福平10mg加1ml乙腈)溶解,再用溶剂定量稀释制成每1ml中约含利福平1mg的溶液,滤过,取续滤液。
溶剂、对照品溶液、杂质对照品溶液(1)~(3)、系统适用性溶液、灵敏度溶液、色谱条件、系统适用性要求与测定法 见利福平有关物质项下。
限度 供试品溶液色谱图中如有杂质峰,醌式利福平、N-氧化利福平、3-甲酰利福霉素SV按外标法以峰面积计算,分别不得过标示量的2.0%、1.0%、0.5%;其他杂质按主成分外标法以峰面积计算,其他杂质总量不得过标示量的3.5%,小于灵敏度溶液主峰面积的峰忽略不计。
干燥失重 取本品的内容物,在105℃干燥至恒重,减失重量不得过2.0%(通则0831)( (通则0831))。
(通则0831))。
溶出度 照溶出度与释放度测定法(通则0931第一法)测定。
溶出条件 以盐酸溶液(9→1000)900ml为溶出介质,转速为每分钟50转,依法操作,经45分钟时取样。
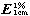
限度 标示量的75%,应符合规定。
其他 应符合胶囊剂项下有关的各项规定(通则0103)( (通则0103))。
(通则0103))。
【含量测定】照高效液相色谱法(通则0512)( (通则0512))测定。临用新制或存放于2~8℃条件下6小时内使用。
(通则0512))测定。临用新制或存放于2~8℃条件下6小时内使用。
供试品溶液 取装量差异项下的内容物,混合均匀。精密称取适量(约相当于利福平0.1g),加少量乙腈(约利福平10mg加1ml乙腈)溶解,再用乙腈-水(1:1)定量稀释制成每1ml中约含利福平1mg的溶液,滤过,精密量取续滤液适量,用乙腈-水(1:1)定量稀释制成每1ml中约含利福平0.1mg的溶液。
对照品溶液、系统适用性溶液、色谱条件、系统适用性要求与测定法 见利福平含量测定项下。
【类别】同利福平。
【规格】(1)0.15g (2)0.3g
【贮藏】密封,在阴暗干燥处保存。
继续阅读
在线查询结果来源于2020年版中国药典,仅供参考。由专业团队进行审核校对。

