这两年一直关注国家局发布的与药品、器械相关的法律法规、规章制度等相关文件,一直通过周报与月报坚持分享我们的所感、所悟,周报与月报中有很多不足与缺点,在新的一年里,博普将持续关注国家政策动向,继续进步,为各位关心的朋友分提供我们所能帮助的、感触的,也希望各位朋友在新的一年里事业有成、万事如意,身体健康、百事百顺!
药品板块
1、说明书修订
2023-01-16 国家药监局关于修订卡络磺钠制剂说明书的公告(2023年第10号)
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对卡络磺钠制剂(包括注射用卡络磺钠、卡络磺钠注射液、卡络磺钠氯化钠注射液、卡络磺钠片)说明书内容进行统一修订。现将有关事项公告如下:
备案要求:上述药品的上市许可持有人均应依据《药品注册管理办法》等有关规定,按照卡络磺钠注射剂/卡络磺钠片说明书修订要求(见附件1、2),于2023年4月12日前报省级药品监督管理部门备案。
标签说明书更换:修订内容涉及药品标签的,应当一并进行修订,说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换。
安全性研究:药品上市许可持有人应当对新增不良反应发生机制开展深入研究,采取有效措施做好药品使用和安全性问题的宣传培训,指导医师、药师合理用药。
医生用药:临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。
患者用药:患者用药前应当仔细阅读药品说明书,使用处方药的,应严格遵医嘱用药。
监管要求:省级药品监督管理部门应当督促行政区域内上述药品的药品上市许可持有人按要求做好相应说明书修订和标签、说明书更换工作,对违法违规行为依法严厉查处。


2023-01-16 国家药监局关于修订昂丹司琼制剂说明书的公告(2023年第12号)
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对昂丹司琼制剂(包括盐酸昂丹司琼片、盐酸昂丹司琼胶囊、盐酸昂丹司琼口腔崩解片、昂丹司琼口溶膜、盐酸昂丹司琼注射液、盐酸昂丹司琼氯化钠注射液、盐酸昂丹司琼葡萄糖注射液、注射用盐酸昂丹司琼)说明书内容进行统一修订。现将有关事项公告如下:
备案要求:上述药品的上市许可持有人均应依据《药品注册管理办法》等有关规定,按照昂丹司琼注射制剂/昂丹司琼口服制剂说明书修订要求(见附件1、2),于2023年4月12日前报国家药品监督管理局药品审评中心或省级药品监督管理部门备案。
标签说明书更换:修订内容涉及药品标签的,应当一并进行修订,说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换。
安全性研究:药品上市许可持有人应当对新增不良反应发生机制开展深入研究,采取有效措施做好药品使用和安全性问题的宣传培训,指导医师、药师合理用药。
医生用药:临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。
患者用药:患者用药前应当仔细阅读药品说明书,使用处方药的,应严格遵医嘱用药。
监管要求:省级药品监督管理部门应当督促行政区域内上述药品的药品上市许可持有人按要求做好相应说明书修订和标签、说明书更换工作,对违法违规行为依法严厉查处。


2023-01-16 国家药监局关于修订盐酸赖氨酸注射剂说明书的公告(2023年第11号)
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对盐酸赖氨酸注射剂(包括盐酸赖氨酸注射液、注射用盐酸赖氨酸、盐酸赖氨酸氯化钠注射液、盐酸赖氨酸葡萄糖注射液)说明书内容进行统一修订。现将有关事项公告如下:
备案要求:上述药品的上市许可持有人均应依据《药品注册管理办法》等有关规定,按照盐酸赖氨酸注射剂说明书修订要求(见附件),于2023年4月12日前报省级药品监督管理部门备案。
标签说明书更换:修订内容涉及药品标签的,应当一并进行修订,说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换。
安全性研究:药品上市许可持有人应当对新增不良反应发生机制开展深入研究,采取有效措施做好药品使用和安全性问题的宣传培训,指导医师、药师合理用药。
医生用药:临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。
患者用药:患者用药前应当仔细阅读药品说明书,使用处方药的,应严格遵医嘱用药。
监管要求:省级药品监督管理部门应当督促行政区域内上述药品的药品上市许可持有人按要求做好相应说明书修订和标签、说明书更换工作,对违法违规行为依法严厉查处。

2、产品上市
2023-01-16 国家药监局批准托珠单抗注射液生物类似药上市
国家药品监督管理局批准百奥泰生物制药股份有限公司申报的托珠单抗注射液(商品名:施瑞立)上市。该药是国内获批的首个托珠单抗注射液生物类似药,适应症为类风湿关节炎、全身型幼年特发性关节炎和细胞因子释放综合征。
托珠单抗是一种重组人源化抗人白介素6(IL-6)受体单克隆抗体,可特异性地结合可溶性和膜结合性IL-6受体,并抑制由IL-6受体介导的信号转导。目前,托珠单抗注射液被纳入《新型冠状病毒感染诊疗方案(试行第十版) 》和《新型冠状病毒感染重症病例诊疗方案(试行第四版)》,对于重症病例且实验室检测 IL-6水平明显升高者可试用。
2023-01-18 国家药监局批准第二个国产托珠单抗注射液生物类似药上市
国家药品监督管理局批准珠海市丽珠单抗生物技术有限公司申报的托珠单抗注射液(商品名:安维泰)上市。该药是国内获批的第二个国产托珠单抗注射液生物类似药,适应症为类风湿关节炎。
托珠单抗是一种重组人源化抗人白介素6(IL-6)受体单克隆抗体,可特异性地结合可溶性和膜结合性IL-6受体,并抑制由IL-6受体介导的信号转导。目前,托珠单抗注射液被纳入《新型冠状病毒感染诊疗方案(试行第十版)》和《新型冠状病毒感染重症病例诊疗方案(试行第四版)》,对于重症病例且实验室检测 IL-6水平明显升高者可试用。
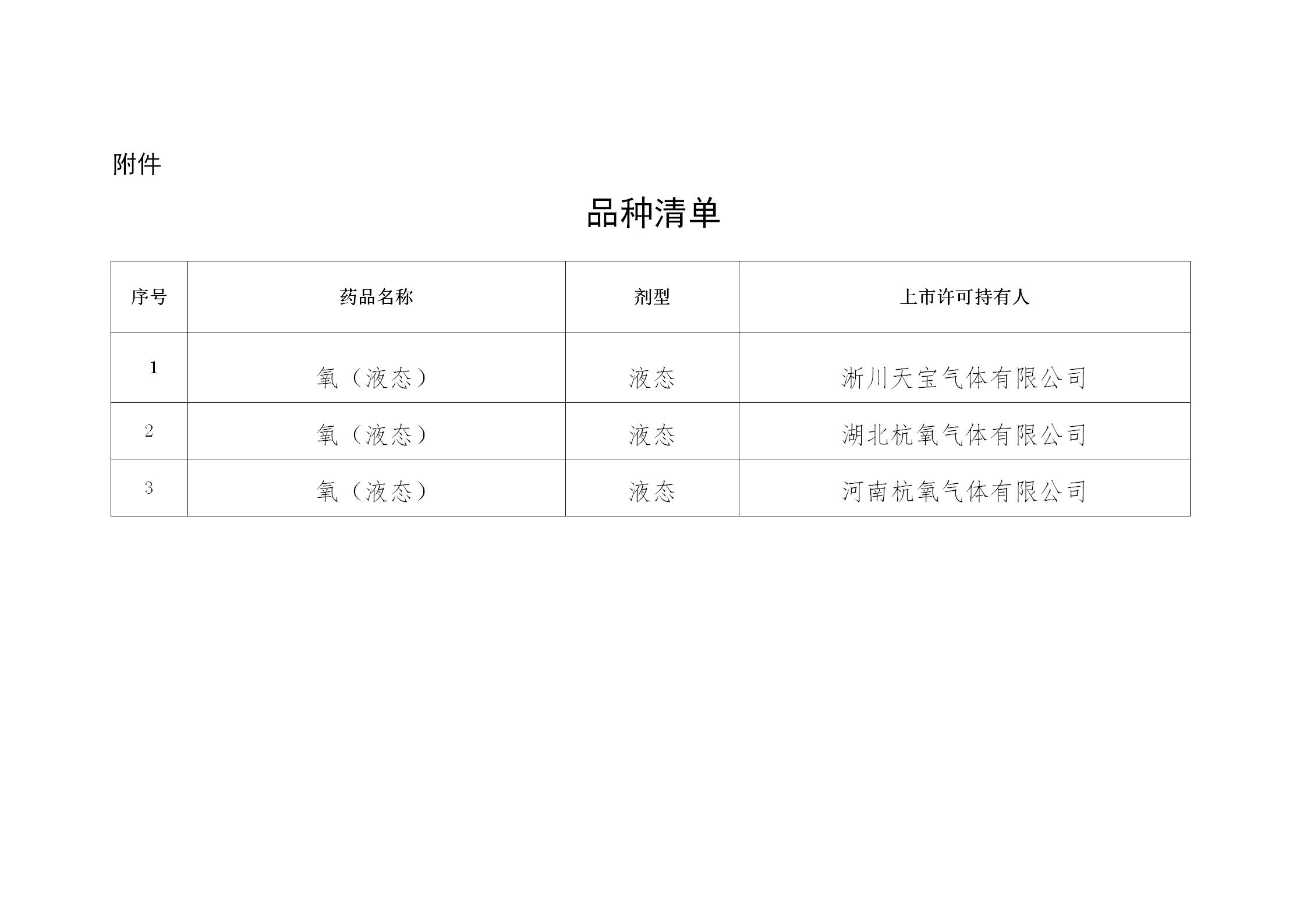
2023-01-17 国家药监局批准10个医用氧产品上市
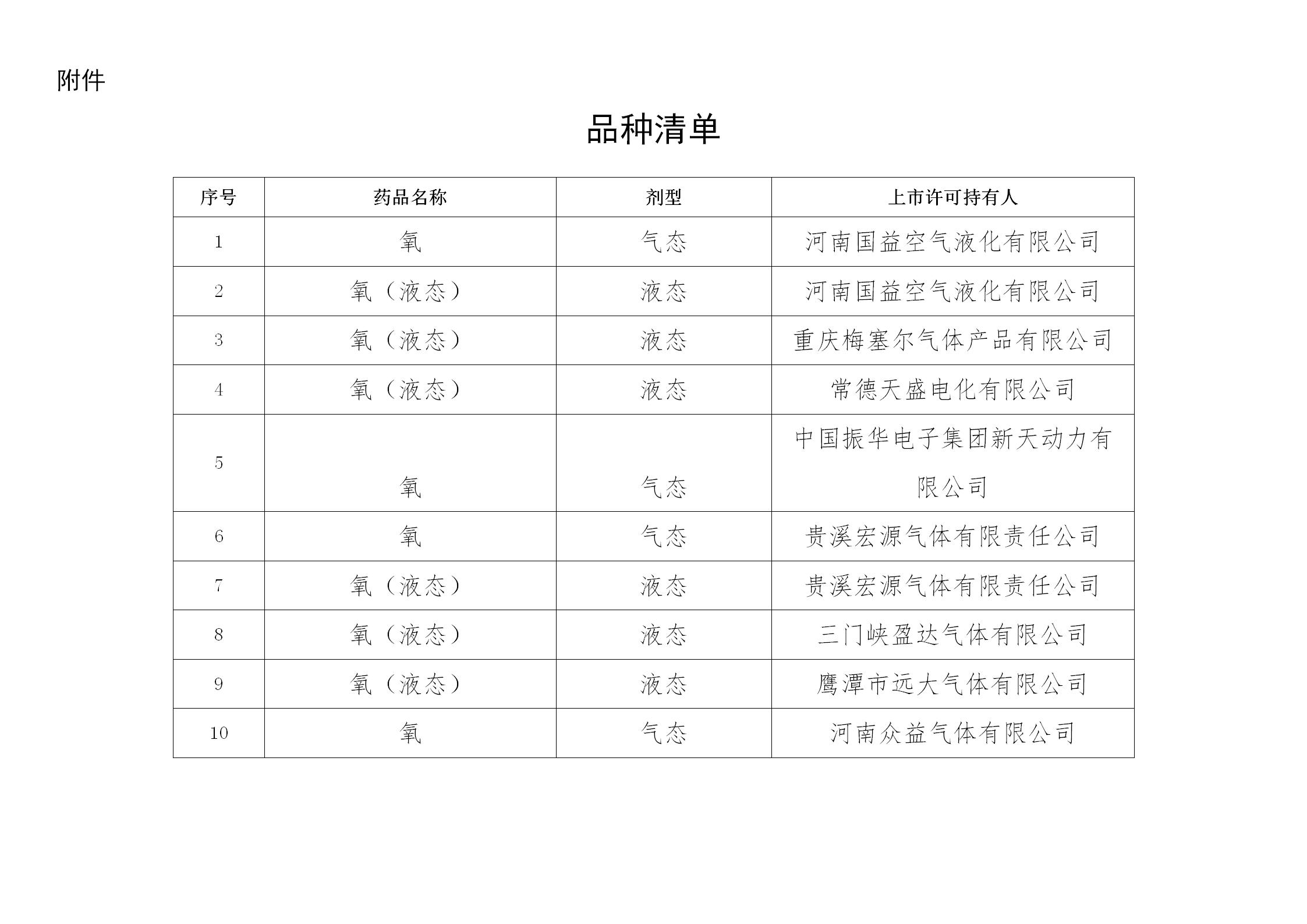
2023-01-20 国家药监局批准3个医用氧产品上市
3、中药品种保护
2023-01-17 2023年1月17日中药品种保护受理公示

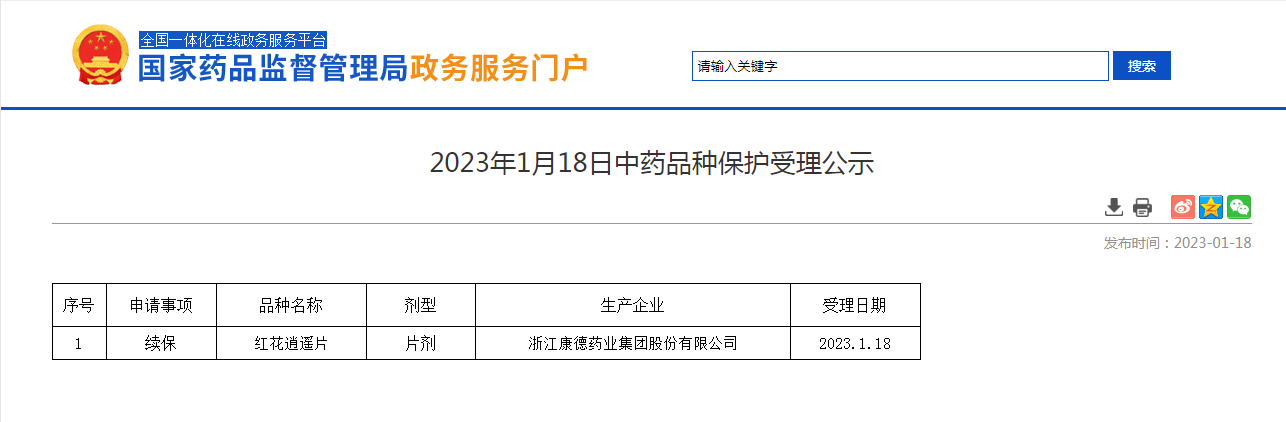
2023-01-18 2023年1月18日中药品种保护受理公示
国家局发布浙江康德药业集团股份有限公司生产的红花逍遥片续保受理;
4、标准草案公示
2023-01-16 关于征求《中国药典》临界胶束浓度测定指导原则草案意见的函
按照工作规划,药典委组织草拟了《临界胶束浓度测定指导原则》草案,现就标准草案征求相关单位意见。本次征求意见为期1个月,请将反馈意见表以EXCEL电子版形式发送至联系邮箱(suncmpharm@ cpu.edu.cn)
2023-01-16 关于征求《中国药典》药品包装用塑料容器及组件通则及配套通用检测方法草案(第一批)意见的函
按照工作规划,药典委组织草拟了5个药品包装用塑料容器及组件相关通则和9个配套通用检测方法草案,现就标准草案征求相关单位意见。本次征求意见为期1个月,请将反馈意见表以EXCEL电子版形式发送至联系邮箱。【luweiyi@shpmcc.com(附件1-5); sdzxhx@126.com(附件6)】

2023-01-16 关于甘露醇药用辅料标准草案的公示(第二次)
药典委拟制定甘露醇药用辅料标准,为确保标准的科学性、合理性和适用性,现将拟制定的标准第二次公示征求社会各界意见。公示期自发布之日起1个月。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱【电子邮箱:475@chp.org.cn】
5、指导原则及管理办法
2023-01-19 国家药监局药审中心关于发布《慢性淋巴细胞白血病新药临床研发技术指导原则》的通告(2023年第1号)
为鼓励抗肿瘤新药研发,在国家药品监督管理局的部署下,药审中心组织制定了《慢性淋巴细胞白血病新药临床研发技术指导原则》。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
2023-01-19 国家药监局关于发布《药物非临床研究质量管理规范认证管理办法》的公告(2023年第15号)
为进一步规范药物非临床研究质量管理规范认证和监督管理工作,国家药品监督管理局组织修订了《药物非临床研究质量管理规范认证管理办法》,现予发布。自2023年7月1日起施行。
6、公告通知
2023-01-16 国家药监局公布第四批药品安全专项整治典型案例
2022年年初以来,为贯彻落实党中央、国务院有关加强药品安全工作的决策部署,国家药监局以严查违法、严控风险为主线,在全国范围内组织开展药品安全专项整治行动。各地药品监管部门持续加大监管执法力度,严厉打击危害药品安全违法行为,查处了一批违法违规案件,切实维护人民群众身体健康和用药安全。现公布第四批药品安全专项整治典型案例。
2023-01-18 五部门联合发布《药品行政执法与刑事司法衔接工作办法》
日前,国家药监局、市场监管总局、公安部、最高人民法院、最高人民检察院联合印发了《药品行政执法与刑事司法衔接工作办法》(以下简称《办法》)。《办法》自2023年2月1日起施行。
《办法》的制定和发布,强化多部门联合查处大案要案,加强对药品行刑衔接工作规范和指导,优化行刑衔接流程,将更好地推进“两法两条例”、《刑法修正案(十一)》和“两高”《关于办理危害药品安全刑事案件适用法律若干问题的解释》的落地实施,严厉打击药品领域违法犯罪行为,切实维护人民群众生命安全和身体健康,有力助推药品安全专项整治工作取得实效。
《办法》共六章四十六条,重点在五个方面对行刑衔接工作进行了完善。
2023-01-19 国家药监局综合司 国家卫生健康委办公厅关于加快推进注射用A型肉毒毒素追溯体系建设工作的通知
为进一步加强注射用A型肉毒毒素管理,实现药品全流程可追溯,保障公众用药安全,根据《中华人民共和国药品管理法》《医疗用毒性药品管理办法》(国务院令第23号)等法律法规,按照《“十四五”国家药品安全及促进高质量发展规划》有关要求,现将有关事宜通知如下:
器械板块
1、产品注销与上市
2023-01-16 国家药监局关于注销髋臼衬垫医疗器械注册证书的公告(2023年第7号)
按照《医疗器械监督管理条例》规定,根据企业申请,现注销微创骨科股份有限公司 MicroPort Orthopedics,Inc.以下1个产品的医疗器械注册证书:髋臼衬垫 LINEAGE Acetabular Liner注册证号:国械注进20163130386。
2023-01-17 第二款国产ECMO产品获批上市
2023年1月17日,国家药监局经审查,采用附条件批准方式,应急批准了航天新长征医疗器械(北京)有限公司研发的体外肺支持辅助设备注册上市。该产品是第二款获批的国产ECMO产品。该产品在体外循环过程中提供动力及安全监测,与兼容的一次性使用耗材联合使用,实现肺功能辅助支持。该产品适用于急性呼吸衰竭、其他治疗方法难以控制并有可预见的病情持续恶化或死亡风险的成人患者。
2、行业标准公告
2023-01-16 国家药监局关于发布YY 0054-2022《血液透析设备》等32项医疗器械行业标准的公告(2023年第8号)
YY 0054-2022《血液透析设备》等32项医疗器械行业标准已经审定通过,现予以公布。

2023-01-16 国家药监局关于成立医疗器械可靠性与维修性标准化技术归口单位的公告(2023年第9号)
为推动医疗器械产业高质量发展,贯彻落实《国家药品监督管理局 国家标准化管理委员会关于进一步促进医疗器械标准化工作高质量发展的意见》,进一步完善医疗器械标准化组织体系,国家药监局决定成立医疗器械可靠性与维修性标准化技术归口单位。
医疗器械可靠性与维修性标准化技术归口单位主要负责医疗器械可靠性和维修性相关基础标准和方法标准的制修订工作。基础标准包括术语定义与通用要求等;方法标准以可靠性与维修性的设计分析与验证评价为核心内容,建立相关通用方法标准和应用指南标准。

