药品板块
1.说明书修订
1.1. 2023年01月09日 国家药监局关于修订伊班膦酸钠注射液说明书的公告(2023年第2号)
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对伊班膦酸钠注射液说明书内容进行统一修订。现将有关事项公告如下:

1.2. 2023年01月09日 国家药监局关于修订胸腺肽注射剂说明书的公告(2023年第3号)
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对胸腺肽注射剂(包括注射用胸腺肽、胸腺肽注射液和胸腺肽氯化钠注射液)说明书内容进行统一修订。现将有关事项公告如下:

2.仿制药参比目录
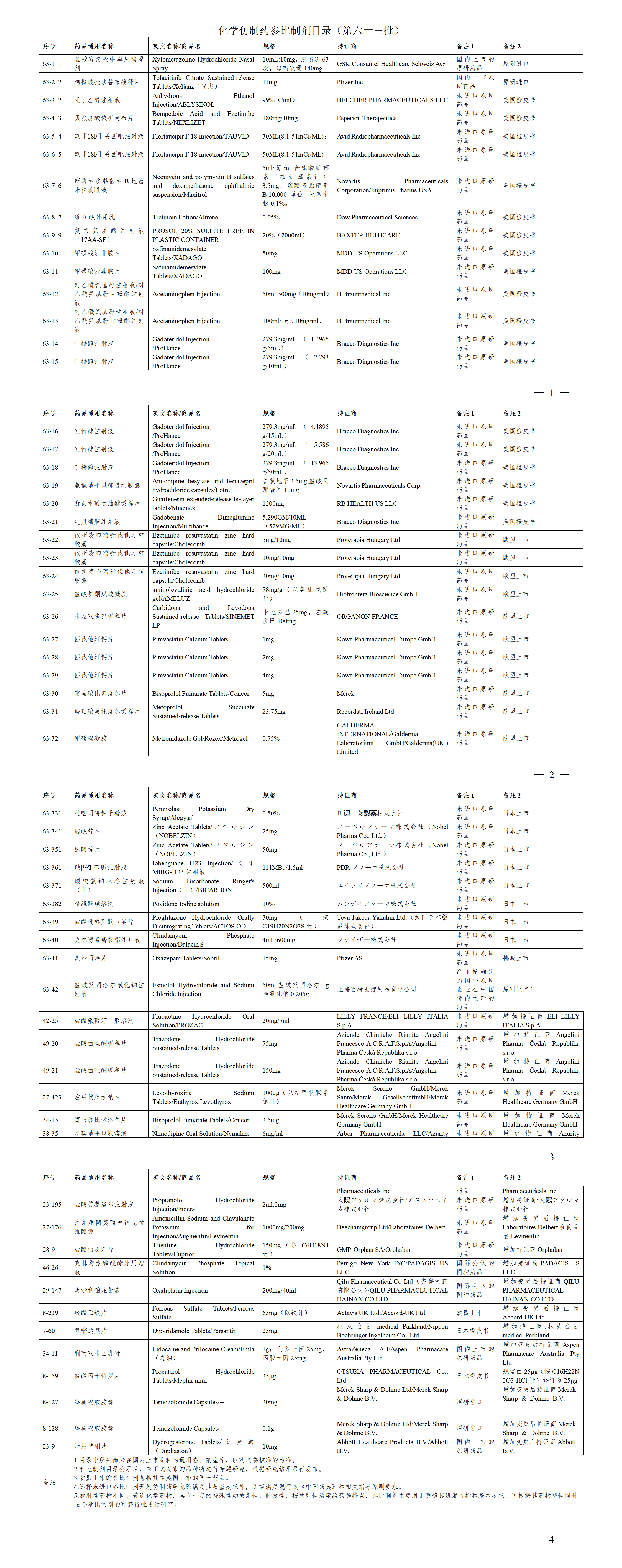
2023年01月09日 国家药监局关于发布仿制药参比制剂目录(第六十三批)的通告(2023年第1号)
经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第六十三批)。
3.中药保护
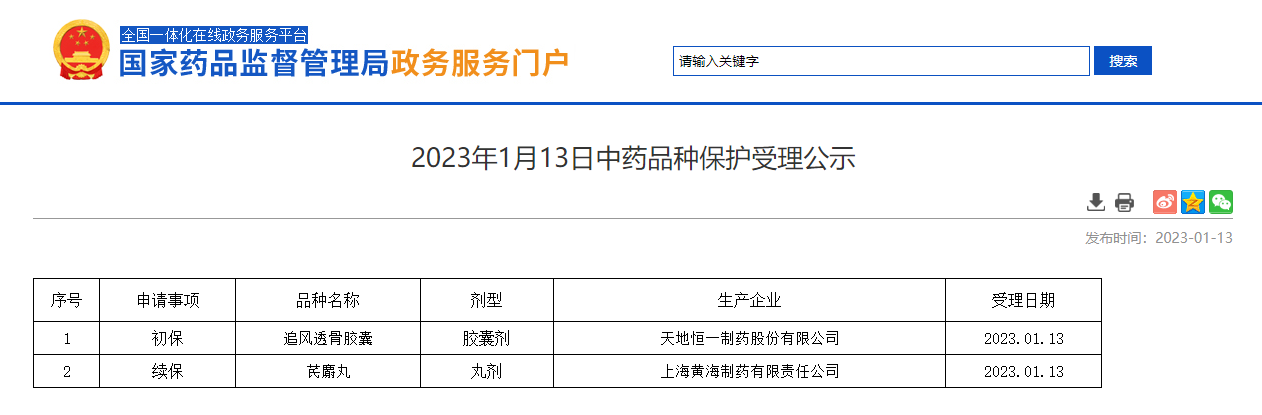
2023年1月13日中药品种保护受理公示
4.非处方药转换换
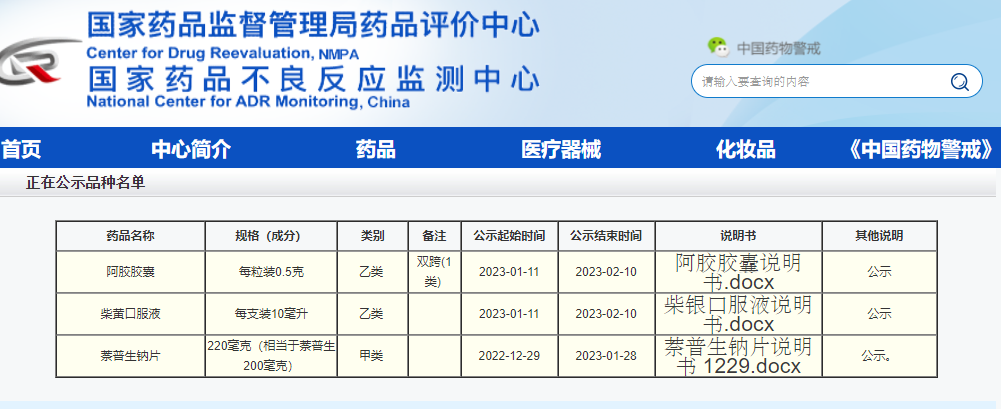
国家药品评价中心2023年01月13日发布非处方药转换阿胶胶囊和柴黄口服液的公示
5.国家中药饮片炮制规范(第一批)
2023年01月09日 关于转发第一批国家中药饮片炮制规范的通知
经国家药品监督管理局批准,第一批22个国家中药饮片炮制规范已正式颁布,现在药典委网站予以转发!

6.标准草案公示
2023年01月11日 关于消石片国家药品标准草案的公示
药典委拟修订消石片国家药品标准,标准编号:WS3-B-3474-98、WS3-B-3474-98-1。为确保标准的科学性、合理性和适用性,现将拟修订的消石片国家药品标准公示征求社会各界意见。公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱(zy@chp.org.cn)。
2023年01月11日 关于药包材环氧乙烷测定法标准草案的公示
药典委拟制定药包材环氧乙烷测定法标准,为确保标准的科学性、合理性和适用性,现将拟制定的标准公示征求社会各界意见。公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱(475@chp.org.cn)。
2023年01月11日 关于滴点测定法标准草案的公示
药典委拟制定滴点测定法标准,为确保标准的科学性、合理性和适用性,现将拟制定的标准公示征求社会各界意见。公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱(475@chp.org.cn)。
器械板块
2023年01月10日 国家药监局关于批准注册339个医疗器械产品公告(2022年12月)(2023年第4号)
2022年12月,国家药监局共批准注册医疗器械产品339个。其中,境内第三类医疗器械产品273个,进口第三类医疗器械产品37个,进口第二类医疗器械产品25个,港澳台医疗器械产品4个。2022年共批准注册医疗器械产品2500个。

