2022-12-21 关于公开征求《罕见疾病药物开发中疾病自然史研究指导原则》意见的通知
为推动和规范我国罕见疾病的疾病自然史研究,药审中心相关适应症小组组织撰写了《罕见疾病药物开发中疾病自然史研究指导原则(征求意见稿)》。征求意见时限为自发布之日起1个月。
该指导原则,主要内容包括:疾病自然史研究定义、应用、模式以及实施。疾病自然史研究的应用内容主要包括:选择特定患者人群、精准研究设计、识别和开发生物标志物、评估和建立临床结局评估工具、作为外部对照数据和其他应用场景。研究模式主要包括回顾性研究与前瞻性研究、横断面研究与纵向研究。实施内容包括及早规划和实施、鼓励患者群体的参与、数据采集、受试者保护。其他相关知识见下图:

2022-12-21 国家药监局药审中心关于发布《中药新药用于慢性胃炎的临床疗效评价技术指导原则(试行)》的通告
为推动构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,探索符合中医药特点的疗效评价标准,在国家药品监督管理局的部署下,药审中心组织制定了《中药新药用于慢性胃炎的临床疗效评价技术指导原则(试行)》。现予发布,自发布之日起施行。

2022-12-21 国家药监局药审中心关于发布《中药新药用于胃食管反流病的临床疗效评价技术指导原则(试行)》的通告
为推动构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,探索符合中医药特点的疗效评价标准,在国家药品监督管理局的部署下,药审中心组织制定了《中药新药用于胃食管反流病的临床疗效评价技术指导原则(试行)》。现予发布,自发布之日起施行。

2022-12-22 关于公开征求《预防用疫苗免疫原性桥接临床试验技术指导原则(征求意见稿)》意见的通知
免疫原性是预防用疫苗评价的重要手段之一,通过免疫原性桥接临床试验(简称免疫桥接试验),比较疫苗在不同条件下引起的免疫应答和安全性特征,可推测和借鉴疫苗的安全有效性。免疫桥接试验有特定的适用领域和设计特点,为指导申请人科学和合理的开展规范的免疫桥接试验,药审中心撰写了《预防用疫苗免疫原性桥接临床试验技术指导原则(征求意见稿)》。征求意见时限为自发布之日起1个月。

2022-12-22 关于公开征求ICH《S1B(R1):致癌性研究》实施建议和中文版的通知
为推动新修订的ICH指导原则在国内的平稳落地实施,药审中心拟定了《S1B(R1):致癌性研究》实施建议,同时组织翻译中文版。现对S1B(R1)实施建议和中文版公开征求意见,为期1个月。
实施建议:申请人可在现行S1指导原则的基础上,参考S1B(R1)指导原则的建议开展研究;本公告发布之日起6个月后开始的相关研究,均适用S1B(R1)指导原则。同时,S1A、S1B、S1C(R2)指导原则仍然适用。研究起始时间的认定遵照《药物非临床研究质量管理规范》中相关规定执行。
2022-12-22 关于公开征求《非阿片类术后镇痛新药临床试验设计技术指导原则》意见的通知
非阿片类术后镇痛领域进入临床试验阶段的创新药和改良型新药逐年增多,为科学引导和规范我国此类药物的临床研发,药品审评中心组织撰写了《非阿片类术后镇痛新药临床试验设计技术指导原则》,并形成征求意见稿。征求意见时限为自发布之日起1个月。

2022-12-19 国家药典委一次性公示16个标准草案
国家药典委对聚维酮K30、三乙醇胺、甘油磷酸钙等16个药用辅料标准进行修订,并将标准草案进行公示,公示日期持续3个月。

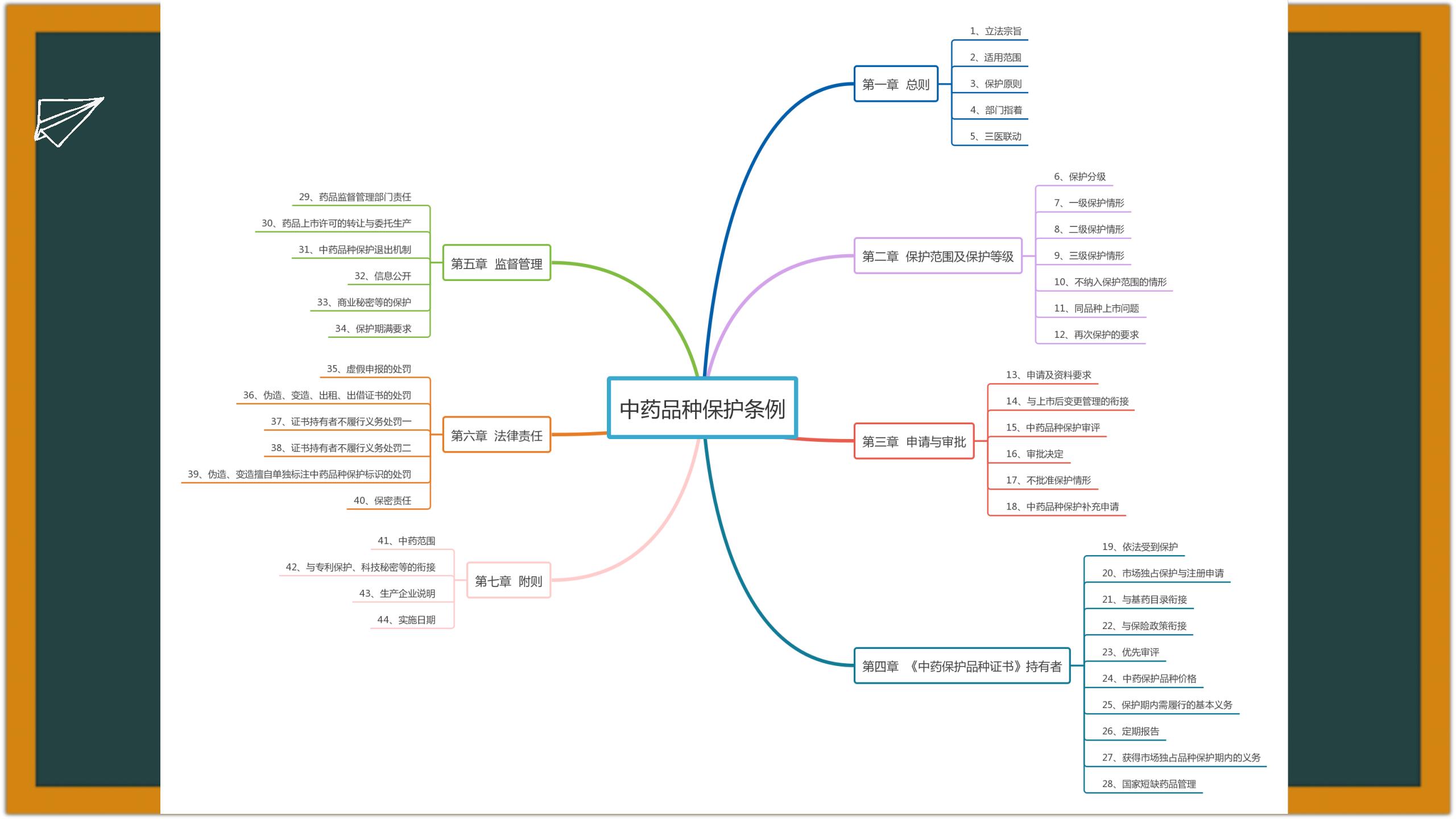
2022-12-23 国家药监局综合司公开征求《中药品种保护条例(修订草案征求意见稿)》意见
为加强中药品种全生命周期管理,推进中药品种质量持续提升,国家药监局组织起草了《中药品种保护条例(修订草案征求意见稿)》,现向社会公开征求意见。公开征求意见时间为2022年12月25日至2023年1月24日。