该部分主要分为三部分:注册检验中常见的无菌检查、问题答疑汇总及其他问题。
1注册检验中常见的无菌检查问题
注册检验中无菌检查问题与微生物限度检查存在很多共同之处,故仅对不同之处进行举例分享。
1.1取样量问题
两个问题:一个是资料中无明确的取样量,如写写按药典要求取样;第二个问题过度强调取样代表性而忽视微生物检验方法的可行性。
个人猜测第一个问题描述模糊有时候是因不自信想蒙混过关,因此此处强调一下如何确认无菌检查取样量。关于无菌检查取样量的确认主要看表1和表3,因为无菌检查时无菌制剂多是全部过滤,使用两联套筒时接入每种培养基的最少量就是半量,因此除非供试品装量<2mL或100mg(需要加倍),按照表1确认检验数量即可。对于表1所说的每种培养基是TSB和FTM,如是薄膜过滤法因为套筒是三联或两联每支供试品均匀分配至TSB和FTM中,通常不需要考虑检验量加倍。
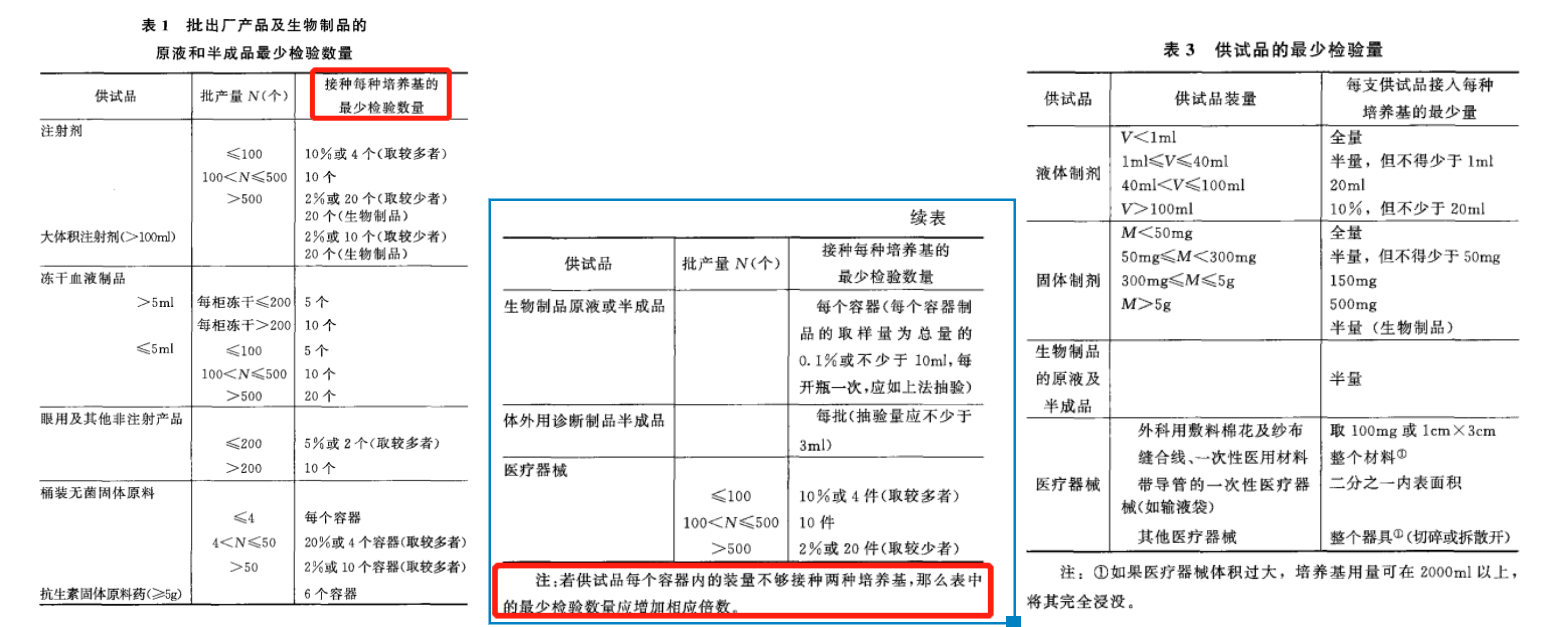
无菌取样表1和表3(图片来源于药典截图,仅供参考交流)
关于第二个问题郑老师距离某抗生素取样量为120瓶,检验量远高于药典标准,为消除抑菌性进行了2h以上的处理,检验冲洗量远高于药典要求。此时虽然取样量很高,但是因为检验方法不可行反而导致检验没有意义。
1.2方法复核通不过
关于方法复核通不过,除了方法重现性差外,常见的原因是方法描述不清晰或委托其他机构进行的方法开发。
不同微生物限度检查的薄膜过滤法,无菌检查方法描述时还需要注意泵速、套筒种类(特别是滤膜)和振摇等细节的描述。对于某些抑菌性强的样品泵速过高时出现供试品溅落在套筒顶部而未被冲洗到而导致方法适用性无法通过;对于某些冻干制剂或预充针制剂需要专用的过滤套筒;某些情况下需要少量多次冲洗或将冲洗液预热或过滤过程中轻摇套筒等操作。在这些细节不明确的时候,标准复核时难免出现各种异常。个人建议就是过程中直面方法开发过程中出现的问题,将操作相关细节落实到方法中。
对于委外开发方法,因为有些时候委外的人员只是研发人员,建议申报前让微生物检验人员复核前期开发的方法甚至进行方法确认。国内即使做的很有名的第三方开发的方法也可能会有坑。曾记得某人说过他们把样品销毁了,但是最后他们在没有样品的情况下出了报告。还有某个小朋友他们老板开了一个人,因为他为了减少项目工作量,所有他经手的实验都是仅对部分动物进行研究。
1.3检测方法与方法与验证资料不一致
此处跟微生物限度检查类似不做赘述。除方法与资料不一致外,还需要注意检测方法的可行性,如培养基浑浊会影响结果观察。

培养基浑浊影响结果观察示例(图片来源于培训课件,仅供学习交流用)
1.4质量标准描述
同微生物一样是文本编辑的问题,上图看一个错误示范。

无菌检查方法描述(来源于培训PPT,仅供学习交流用)
2关于洋葱伯克霍尔德菌
关于洋葱伯克霍尔德菌,目前有公司接到了关于CDE的发补意见:本品味口服溶液剂,请参照USP开展洋葱伯克霍尔德菌的研究,根据风险评估和研究结果采取合理的控制措施。
郑老师提到对于洋葱伯克霍尔德菌单独列还是加入到致病菌还没有统一的定论,目前口服溶液,水分高的产品风险高。同时郑老师举例了某公司的方法并指出了其存在的问题。

洋葱伯克霍尔德菌(来源于培训课件,仅供学习交流用)
1)阳性对照错误,不含供试液。
2)其不进行批批检验的规定不被接受。
洋葱伯克霍尔德菌检验频率的制定依据,不能仅仅依据前一年度的检测结果,还应根据制剂的特性、用药人群、跟要途径、原辅料、水系统等中洋葱伯克霍尔德菌污染风险,以及产品历史洋葱伯克霍尔德菌的检出情况,来综合评估该产品污染洋葱伯克霍尔德菌的风险,进而确定检测频率。
3问题答疑
该部分主要是个人对郑老师答疑问题的总结,因为是个人转述,难免与老师本意存在差距,仅供借鉴参考。
3.1关于快速无菌检查的答案汇总
全自动微生物培养系统(图片来源于网络,仅供学习交流用)
3.1.1是否认可:
快速无菌检查方法认不认可看你产品的对象,现在首先放开的是细胞治疗产品或者是短效期产品。上海在去年有细胞治疗产品使用快速无菌是被认可的。
3.1.2取样量:
细胞治疗冻存产品这类产品的无菌取样量是其实减少的,国外也有相关的法规有规定,可以先参考。细胞治疗冻存产品进行快速无菌也不许按照目前药典规定取样量进行取样。
3.1.3是否还做药典法:
一个产品要上快检法是需要做大量验证的,验证后才能使用快检法。采用快检技术以后要做平行实施期,所谓的平行实施期就是两种方法都要做,积累到一定数量的数据后就可以用快检法。
3.1.4替代方法验证菌株有哪些:
药典菌株肯定要做,建议再加一些环境菌株。只做药典菌株肯定是不够的,药典里面是没有生长缓慢的菌株的。尤其是要看产品。快速无菌和快速微限都有讲究。
3.2操作细节问题
3.2.1均质袋的使用:
不太推荐均质袋,为什么呢?举个例子,口服片剂如果使用均质袋,均质袋它一般是塑料袋,均质时很容易破掉会漏液,所以不好溶解的口服制剂我们一般是会推荐使用热匀浆化好一点。

均质袋(图片来源于网络,仅供学习交流用)
3.2.2匀浆仪需要规定时间和转速规定吗
因为法规上没有提这一块,他没有特定的时间和转速。那么现在问题在哪里呢,匀浆仪我们以前有做过,匀浆仪如果你的匀浆速率很快或者时间很长,它会产生热效应,有些微生物是会死的,尤其像乳酸杆菌等都会死掉。所以我们会有推荐,推荐我们7000RPM,30S就够了。
匀浆仪(图片来源于网络,仅供学习交流用)
但是我要提醒大家在国内几大的比较常见的匀浆供应商里面我们去做过它的转速准不准,事实上很多匀浆仪的转速都不准,比方说它写的是5000RPM事实上我们测出来是10000RPM。所以大家要注意这个问题。并不是国内这个转速都不好,是有几家可能相差都很大。
3.2.3薄膜过滤法可不可以只过滤10mL样品?
10mL可能分布性不好,所以我们建议可以直接过滤。但是要在滤筒里先加一定体积的稀释液,再打10mL样品进去,这样子过滤也是可以的。
3.2.4微生物限度薄膜过滤法可以只制作一张吗?
可以一张也可以2张,制备2张是为了分膜进行。
3.3质量风险管理理念-基于自己的认知做出正确的做法
3.3.1生物制品原液的微生物限度标准一般如何制定?
这个都不一样的,其实这个东西我觉得要根据你的风险进行评估。就是说每个企业对于不同的原液他的限度标准都是不一样的,没有统一的概论的。所以还是要评估你的风险最后你的可接受程度来制定限度标准。
3.3.2植入剂的无菌检查,是需要样品完全溶解吗?能否接受跟医疗器械一样表面浸泡后做薄膜过滤呢?
植入剂应该要做无菌检查。表面浸提是有问题的,表面浸提会有各种问题,这个会有污染等各种问题,如果可以溶解的话最好是样品全溶解做无菌检查。
3.3.3注射剂的原料是不是可以不做控制菌检查,只做需氧菌、霉菌及酵母菌检查?
做不做自行评估后决定。
定那些检项根据你的原辅料来源和生产工艺来定的。根据风险,你可以不定。自己根据风险评估来定。
3.3.4研发中试产品无菌检查需要做方法学验证吗?中试产品量少,和正式上市的生产对比取样量可定不一样,是否按最大取样量进行检验?
需要。可以风险评估一下取样量。
3.3.5微生物检测时限如何制定比较合适?要做那些方面的验证?
3-5;5-7天。历史数据来说明可行性。可以缩短。
3.4其他问题
3.4.1对苯扎溴铵的微生物限度如何规定,应该参考什么标准?
这个不属于药品也不属于原辅料,不是药典参考的,你应该去看消毒剂规范里面,他本身有没有标准呢?因为这个肯定不属于药品或者原辅料,他是消毒剂,消毒剂需要做微生物限度吗?
3.4.2微生物限度标准中102cfu可以接收的最大菌数为200,怎么解读,比如计数结果为150cfu,结果判定是否合格?
基于取样误差和微生物分布不均匀,单次检验的可接受标准是200以内,但不意味着你质量标准的限度是200.
150是合格的。
3.4.3请问无菌检查需要同时做两个阳性对照吗?进口注册标准选择枯草芽孢杆菌做阳性对照,按ChP还要增加金黄色葡萄球菌吗?
对两株菌都特别敏感,可以做两个。如果对枯草芽孢杆菌最敏感,可以只选择枯草芽孢杆菌。
3.4.4需氧菌总数培养3-5天怎么理解?是3天,4天,5天都可以出具报告么?制剂建议培养多久?
一般会选择5天,除非有大量的研究数据可以证明3天也没有问题。
3.4.5培养可以超过7天吗?
生长比较缓慢,要延长超过7天也是可以的。
3.4.6微生物限度检验或无菌的方法适用性检验需要使用三个批次还是可使用一批做三个平行
可以一批做三次独立平行试验。
3.4.7生物冻干制剂检验量是按固体检验量还是按生物制品半量检验?
按固体。
3.4.8供试品无菌检查培养14天后再加供试品阳性,必要性大吗?
与国外药典不一样,国内一定要做阳性的,理论上应该是阳性和检验同时进行的。,但是有些生物药比较昂贵,所以选择培养14天再加阳性,这是法规上要求必须要做的。
4小结
这次培训真的是干货满满,在过程中总有一种感觉大家都想老师给做决定,有些人就是慕名而来要答案的,这样的人太多也许就是各专家老师不愿轻易分享干货。
其实过程中老师除讲到微生物检验申报注册问题外还特别强调了质量风险管理的理念,鼓励企业对自己的产品进行深入研究,基于科学和风险做出决定为患者的用药安全负责。
感谢郑老师的分享。个人学习心得难免存在个人主观理解,欢迎批评指正,请勿过度解读。

