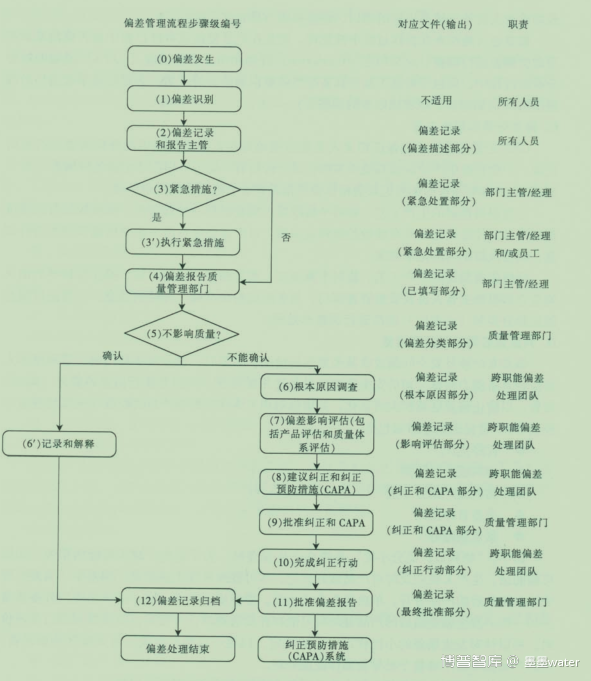
一、偏差发生
1、清晰明确的生产工艺、物料平衡限度、质量标准、检验方法、操作规程等是偏差发生和识别的基础,只有当企业已经建立了保证药品安全性、可靠性和质量可控性所需的必要文件时,才可能发生和识别偏差。
2、任何企业,无论设备多先进,管理多严格,在生产过程中都不可避免地存在发生偏差的可能性,但企业首先应通过完善的组织机构,合理的文件系统和充分的人员培训来最大限度地预防偏差的发生,这是《药品生产质量管理规范?(2010年修订)第二百四十七条所强调的内容:
第二百四十七条各部门负责人应确保所有人员正确执行生产工艺、质量标准、检验方法和操作规程,防止偏差产生。
二、偏差的识别
1、偏差的识别是偏差处理活动的起点。药品生产企业中所有药品生产质量相关人员均应接受偏差管理程序培训,理解偏差概念并具备识别偏差的能力。特别是一线操作员和QA现场检查人员关于偏差识别的培训、经验和能力是非常关键的。
2、偏差也可能没有在操作过程中被发现,而是在记录复核或审核过程中被识别出来。在对此类偏差进行调查、定义纠正行动和纠正预防措施或偏差趋势分析的过程中,应包括对员工是否具备适当偏差识别能力的评估;必要时应采取适当的改进措施(例如培训、职责或职务的调整等)
三、偏差记录和报告
1、GMP记录的设计应能保证相关人员能方便地对生产质量活动中的任何偏差进行及时记录。一般在批生产记录或其他相关的记录上应留有一定的空白用于记录各种偏差(异常情况),并应有完整的偏差记录表格以保证偏差调查处理过程的可追溯性。
2、任何偏离预定的生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况都应以文件形式记录并有清楚地解释或说明。对产品质量有潜在影响的偏差应当进行调查,调查及结论均应记录在案。
3、任何偏离预定的生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况都应立即报告主管人员及质量管理部门,报告时应给出准确、完整的信息,以便进行偏差的正确分类和组织进行调查及处理。
四、判断是否需执行紧急措施
1、偏差有时涉及安全问题或者其他紧急的情况,必要时,偏差发生部门的主管和技术人员应当具备能力根据公司的安全程序或其他适用的程序,判断并执行偏差的紧急处置,以防止偏差继续扩大或恶化,并增强对相关潜在受影响产品的控制。常见的紧急措施包括:
①、暂停生产;
②、物料或产品隔离;
③、物料或产品分小批;
④、设备暂停使用;
⑤、紧急避险等;
2、“物料或产品分小批”是指在发生偏差时,为了避免、减少可能的损失,如果可能的话,生产人员应及时对产品做好标记,尽可能地将发生偏差前、偏差中、偏差处理完恢复正常后的产品分开,单独作为若干小批。根据批的定义,同一批产品应当具备质量的均一性。发生偏差前后的产品显然有可能存在质量差异。分批后,质量管理部门在评价时,可针对发生偏差的小批作出专门的决定。以免一旦需要报废,因无法区分偏差前、后的产品而不得不将整个批次全部报废处理。
3、执行的所有紧急措施都必须在偏差记录中进行及时、完整、详实的记录。
五、偏差报告质量管理部门
1、偏差是否立即报告质量管理部门,是质量管理部门能否有效进行偏差分类和会同其他部门进行调查的前提。
2、偏差发生后,发生部门的主管、技术人员或其授权人员应立即向质量管理部门提供真实全面的偏差信息;建议针对中国GMP2010版第二百五十条中“立即报告主管人员及质量管理部门”的要求,在管理文件中给出“立即”的定义,比如“自偏差发生时1天之内”,以避免各部门在偏差程序执行过程中对“立即报告”的要求产生不同的理解。
偏差处理流程示例: