老规矩,先上图:
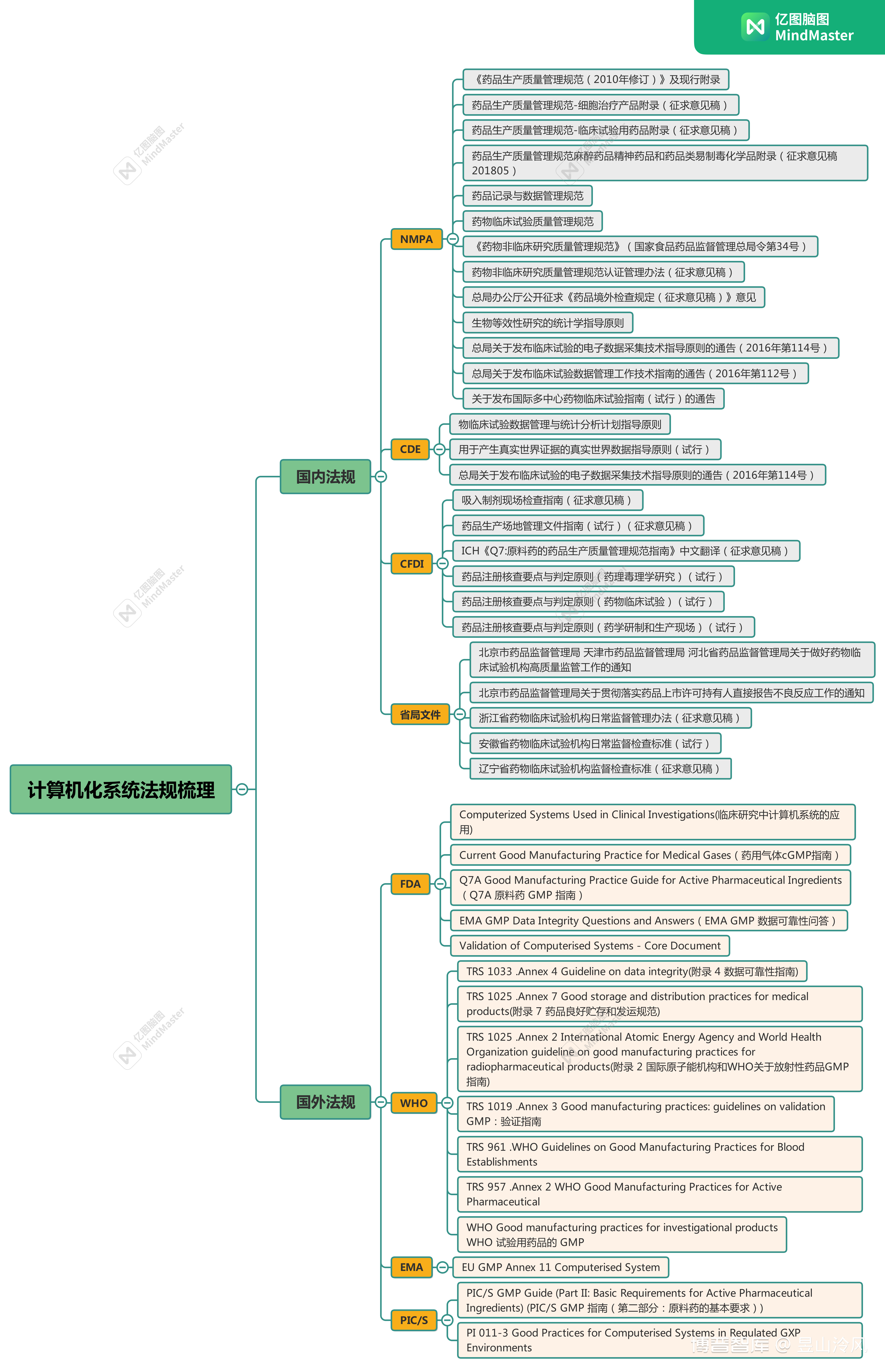
正在学习计算机化系统相关知识,和各位同仁共同交流♡
1.学习计算机化系统相关法规,首先要知道计算机化系统(Computerized system)的基本概念:
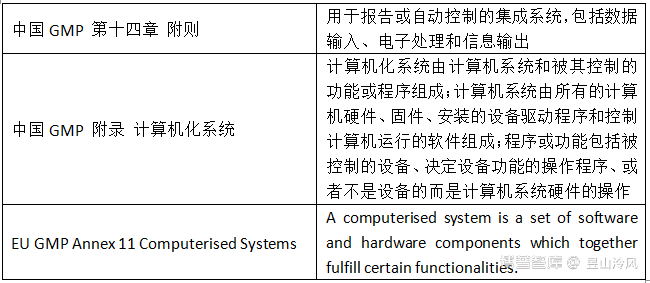
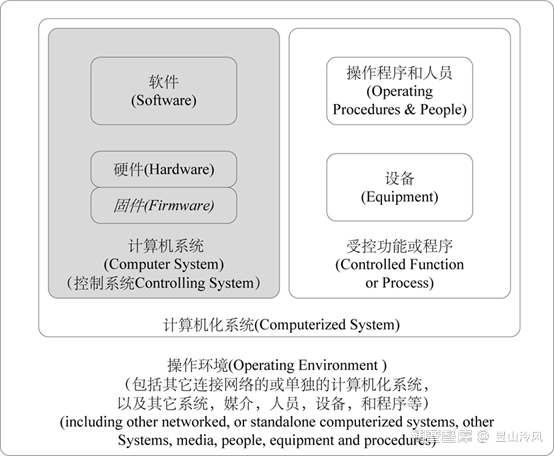
2.计算机化系统组成:计算机化系统由硬件、软件和网络等组件,与受控的功能和相关联的文件组成,示意图如下:
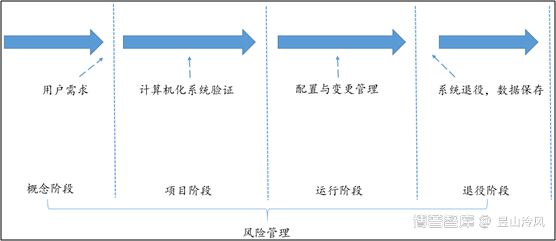
3."计算机化系统的生命周期"包括从初始需求到系统退出的所有阶段,包括系统设计、规范、编程、测试、安装、运行、维护一直到退役。一般可以将系统的全生命周期分为:概念阶段,项目阶段,运行阶段以及退役阶段,如下图:
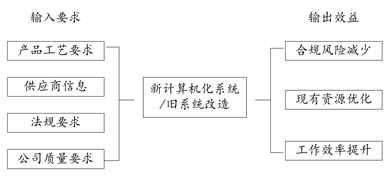
1)概念阶段:公司应根据业务需求和收益来考虑是否要实现其一个或多个GMP业务流程的自动化或信息化。如下图所示,此阶段应提出初始需求,并考虑可能的解决方法,通过对范围、成本和输出效益的初步了解,来决定是否要进入到项目实施阶段。
2)项目阶段:计算机化系统生命周期管理中的项目阶段-也可以具体参考CSV 计算机化系统验证;这个阶段包括项目计划、供应商选择、用户需求文件、系统设计文档,配置与编程技术文件、功能验收环节(包括项目组测试环境下测试功能与用户实际生产环境测试验收)、直到系统正式投入使用。其中规范文件是独立于配置和编程的项目实施步骤,对于某些项目,规范活动是与配置和编程活动紧密结合的,这取决于所采用的软件开发方法。
3)运行阶段:在运行阶段保持系统合规包含许多相互的活动,如下图:
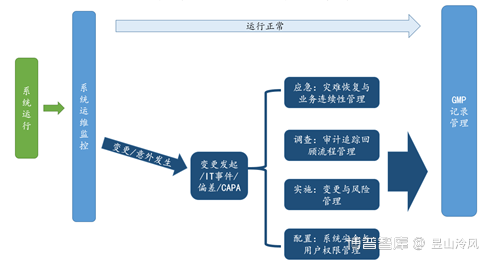
a)一旦系统通过了验收并投入使用,维护系统合规性并符合预定用途必须贯彻落实在整个运行阶段,要达到此目的,对系统的使用、维护与管理应建立最新的、以文件形式存档的规程并进行培训。
b)一个系统的运行阶段可能持续很多年,可能包括对软件、硬件、业务流程和法规要求的变更,需要在任何时候都保持系统及其数据的完整性,并将其作为定期审查的一部分。
c)根据定期审查与评估、运行与性能数据及故障的根本原因分析可以对流程与系统进行改进,从突发事件管理及纠正和预防措施流程中获得的信息对于评估是非常重要的。
d)变更管理应根据规范、设计、验证提供可靠的机制,来实现合理的技术改进。所采取的方法,包括文件和验证范围,应根据变更的风险性和复杂性来确定。
4)退役阶段(具体可以参考GAMP5 附录M10 SystemRetirement):计算机化系统的退役/停用是停止系统、标记系统生命周期终结的正式活动。对于现有系统、数据和流程的潜在影响应在系统退役/停用之前进行评估。 在计算机化系统退役或停用之后,应保证GMP相关的文件和系统中的数据按照GMP要求进行保存,并在保存期内可读。对于系统停用或退役后关键数据的处理,可以考虑下列问题或活动:
a)确定数据将会发生什么情况?
b)是否按照同样的方式处理所有数据?
c)是否应保存部分或所有数据?如果答案为“是”,应采取进一步的措施
d)是否采用相同格式保存数据?
e)是否将数据转换为书面或微缩胶片记录?是否将现有数据转换为标准数据格式(例如,ASCII,PDF,TIFF等)?
f)是否将全部或部分数据转移到其它系统?如果答案为“是”,需要考虑“数据转移” 。
g)对于退役的系统:是否必须对退役的数据进行再处理?
h)在哪里保存退役数据?应根据数据的拥有者、数据保存的形式和数据访问的要求确定
5)如何基于系统的全生命周期进行管理– 应该基于用户如何实际使用系统,通过Process Mapping, 以及software, hardware, personnel, and documentation (Procedure,i.e. SOP)多管齐下,这样才能确保验证之后,系统满足实际使用需要。
4.计算机化系统验证:
1)计算机化系统验证(Computerized System Validation,CSV)是提供正式的评估和报告等文件性的证明,用以确认计算机化系统的全生命周期(包括软件和系统的开发,系统的安装实施,首次确认,操作,修改,重新确认,运维和退役)是按照要求进行的,并且对于使用自动化数据输入/输出(I/Os)的系统,计算机化系统验证还需要确保其电子数据在输入,中间处理,输出过程中的准确性和效率。
2)计算机化系统验证包括应用程序的验证和基础架构的确认,其范围与程度应当基于科学的风险评估。风险评估应当充分考虑计算机化系统的使用范围和用途。
3)应当在计算机化系统生命周期中保持其验证状态。
4)企业应当建立包含药品生产质量管理过程中涉及的所有计算机化系统清单,标明与药品生产质量管理相关的功能。清单应当及时更新。
5)数据转换格式或迁移时,应当确认数据的数值及含义没有改变。
6)计算机系统代替手工操作,应该降低对产品质量,工艺过程控制和质量保证的影响。不应该有增加在此过程的整体风险。
7)要求对用于 GMP 用途的 Excel Spreadsheet 的开发、验证和使用过程做验证并进行管控。根据用途不同将 MS Excel 表格分为两类:第Ⅰ类:使用电子表格生成一个纸质文件(一般是出自文件中的附件)例如:质量事件的跟踪统计(Tracking Quality metrics)、台账清单(Inventory list)。第Ⅱ类:需要进行配置或开发以实现更复杂的应用程序功能,包括基本功能和复杂的计算。例如:分析计算(Analytical calculations)、微软关联式数据库使用自定义宏。
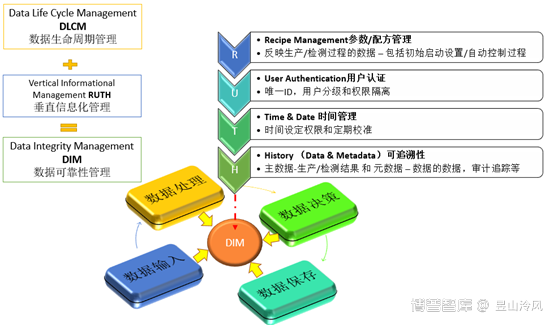
8)诺华 RUTH 计算机化系统验证和数据可靠性管理策略图示:
5.说到计算机化系统,就一定会讲到数据可靠性。英国药品和健康产品管理局(MHRA),针对以下术语列出了定义

1)在数据核对方面,并不期望生产商和分析实验室建立辩证的方法,只要建立并执行这样一个系统就可以:这个系统基于数据可靠性风险提供了一个可以接受的控制状态,并且被完整记录的支持性证据。(参考MHRA GXP DataIntegrity Guidance and Definitions
2)风险管理应当贯穿计算机化系统的生命周期全过程,应当考虑患者安全、数据完整性和产品质量。作为质量风险管理的一部分,应当根据书面的风险评估结果确定验证和数据完整性控制的程度。
6.计算机化系统供应商:
企业应当针对计算机化系统供应商的管理制定操作规程。供应商提供产品或服务时(如安装、配置、集成、验证、维护、数据处理等),企业应当与供应商签订正式协议,明确双方责任。

