本文中观点不代表任何公司和组织,如有觉得有冒犯的地方,请于后台联系,我会及时删除。所有分享案例都具有孤立性,仅供参考。
2018.04.03-2018.04.12 FDA 对ADMA公司一个工厂进行了审计。
检查官:Michele L Forster, Justin A Boyd
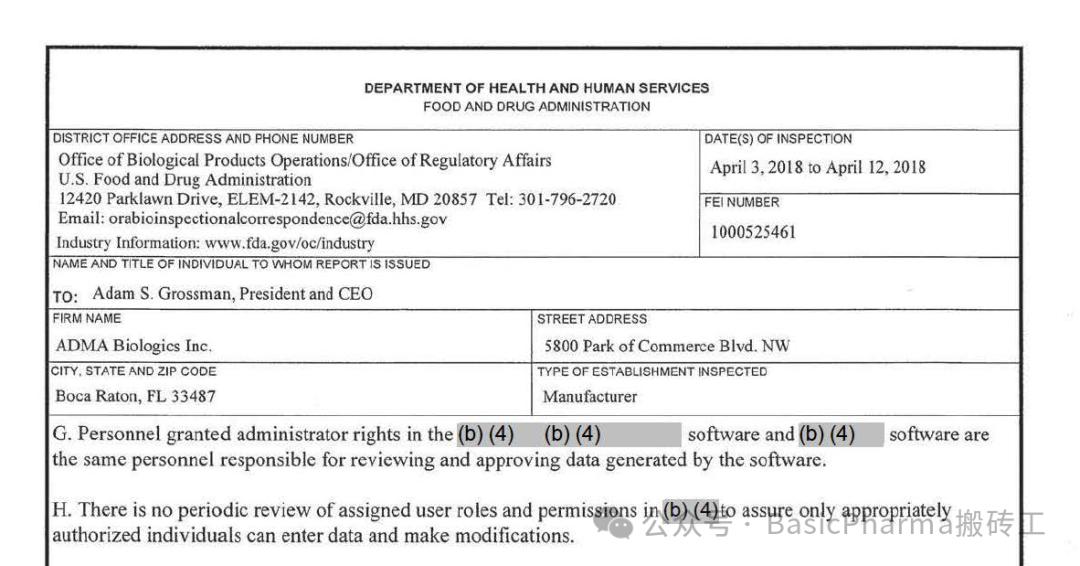

There is no periodic review of assigned user roles and permissions in xxx to assure only appropriately authorized individuals can enter data and make modifications.没有定期审查xxx中分配的用户角色和权限,以确保只有获得适当授权的个人才能输入数据和进行修改。
西门:计算机化系统管理中,项目实施,验证,放行,运维,退役。尤其记得数据完整性必须是全面的,不存在疏漏。
这里有一些FDA检察手册里的描述,阐述为什么查这个……不过一般都可以靠一靠
US FDA CPG 7132a.07,
Computerized Drug Processing; Input/output Checking.
FDA CPGM 7356.002M
Are the computerized system's inputs and outputs checked for accuracy at a degree and frequency based on the complexity and reliability of the system? 是否根据系统的复杂性和可靠性,以一定程度和频率检查计算机化系统的输入和输出的准确性?
其他法规
EU GMP Annex11
Computerised systems should be periodically evaluated to confirm that they remain in a valid state and are compliant with GMP. Such evaluations should include, where appropriate, the current range of functionality, deviation records, incidents, problems, upgrade history, performance, reliability, security and validation status report(s). 应定期评估计算机化系统,以确认其处于有效状态并符合GMP。在适当的情况下,此类评估应包括当前功能范围、偏差记录、事故、问题、升级历史、性能、可靠性、安全性和验证状态报告。
ICH Q7, 12.60
12.6 对已验证的系统的定期审核
12.60 应对系统或工艺过程进行定期的评估,以确认它们仍然处于一个有效的工作状态中,当系统或工艺未发生显著性变化,且质量复查的结果表明该系统或工艺一直在生产符合质量标准的物料,通常不需要进行再验证。
中国GMP附录计算机化系统附录
企业应当指定专人对通用的商业化计算机软件进行审核,确认其满足用户需求。在对定制的计算机化系统进行验证时,企业应当建立相应的操作规程,确保在生命周期内评估系统的质量和性能。
其他
OECD Guidance Document, Section 3.6.
Section 4.6 in WHO QAS19_819. MHRA, Sections 9.3 #5 and 9.8
21CFR Part 11.10(k); 11.300(b)
21CFR Part 211.68; 211.180


