这是CSV胡大侠专栏文章第14篇,欢迎大家多多关注支持
CSV胡大侠 - 系列文章专栏
CSV胡大侠 - 博普视频课传送门
快速导读
1. 性能监控 Performance Monitoring ; 定期审查(周期性回顾)Periodic Review;以及再确认与再验证 Re-qualification & Re-validation 三种系统运维手段的目的都是为了维持计算机化系统的验证受控状态(Remain in a validstatus)评估手段为主且足矣测试手段为辅并需分析前两者数据
2. 性能监控 Performance Monitoring - 是总体预防性维修监测系统的性能,用于诊断系统问题,降低系统的停机故障时间。某一些重要指标
3. 定期审查Periodic Review-是总体预防性维修功能表现、偏差记录、事件、问题、升级历史、性能、可靠性、安全性、验证报告维持在有效的验证状态整体情况
4. 再验证Re-validation – 是指一项生产工艺验证状态有没有发生变化而进行的验证活动周期性再验证变更千差万别,本次不讨论工艺整体人机料法环

MIT科技月刊:未来自动化系统的运维工程师:People or 系统本身?
1. 法规要求 – 为什么需要考虑“性能监测/定期审查/再确认&再验证”
1.0 对于计算机化系统,需满足1.日常工作 – 系统性能监测2.周期性回顾 – 系统状态报告
1.中国GMP> GMP 计算机化系统 第四章 验证 第六条 风险评估
应当在计算机化系统生命周期中保持其验证状态
2. 药品记录与数据管理要求试行 2020年12月1日正式执行第四章 电子记录管理要求
第二十条
(一)安装在适当的位置,以防止外来因素干扰
(二)支持系统正常运行的
(三)稳定、安全
(四)实现相关部门之间、岗位之间信息传输和数据共享
1.1 对于CSV涉及的生产工艺与检验方法的合规要求:必要时,进行再确认
l 中国GMP 第七章 确认与验证[1]确认和验证不是一次性的行为再确认或再验证操作规程
l 中国GMP 无菌附录[2]灭菌工艺的有效性
l 中国GMP 确认与验证附录[3]定期评估操作规程风险管理质量管理体系文件验证必要时,进行再确认验证状态未发生重大变化设施、设备和工艺等的回顾审核满足再确认或再验证的要求
更多欧美法规参考:EU GMP Chapter 5 Production[5]欧盟GMP Annex 11 Computerised Systems11. Periodic evaluationGood manufacturing practices: guidelines on validation[6]

计算机化系统验证只是其中的一种验证“计算机化系统验证” 和“工艺验证”的不同的特性
2. 计算机化系统验证的特性决定 以性能监测与周期性回顾
2.0 CSV验证的对象的验证状态
参考GAMP5定义,计算机化系统(Computerized System)由控制部分(Computer System):硬件【如:服务器】+软件【如:SAP程序】;和被控制部分(Controlled Functionor Equipment):流程和人 【使用SAP完成样品流程的理化分析员】+ 下属仪器设备【HPLC,GC仪器】
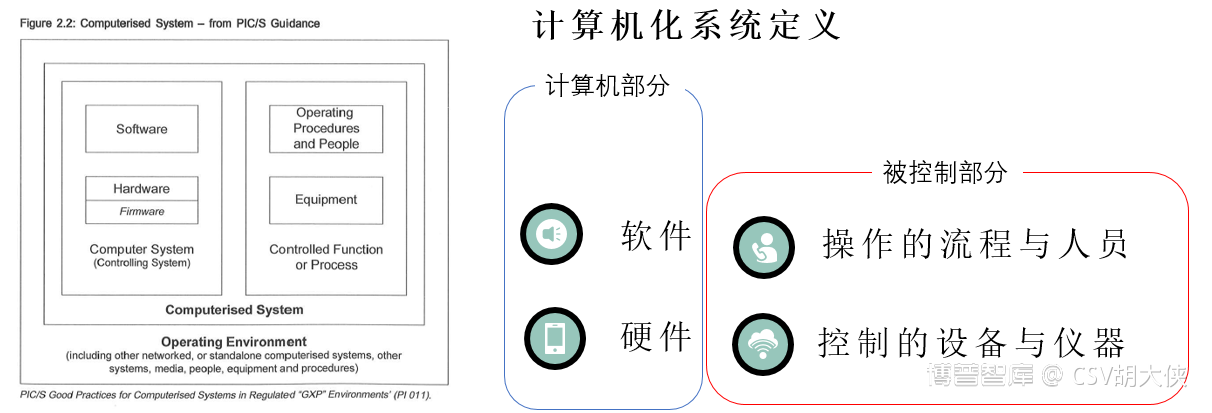
2.1 GAMP 5 基于风险的良好自动化生产实践鼓励通过实时监测和定期回顾
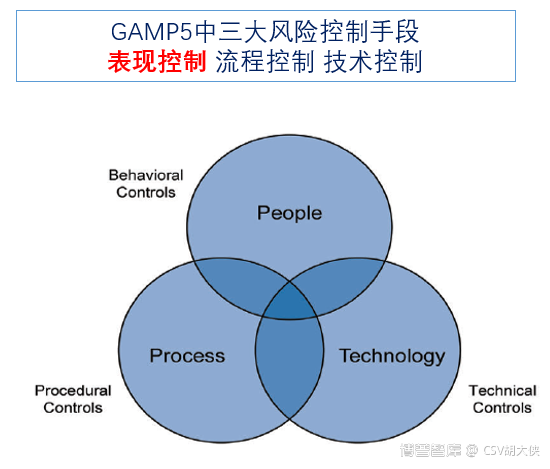
计算机系统(软件+硬件)技术控制(Technical Controls)和流程管控(Procedural Control)过程控制+质量保障直接的实时监控

实时显示与报错
2.计算机化系统的被控制部分之一下属仪器和设备时刻关注其运行状况(性能监测+周期性回顾)定期更换或者校准(再验证):

3 计算机化系统的被控制部分之二控制流程和操作人系统性能监测的也能间接反映其好坏(比如OEE,成品率等)长期系统的周期性回顾(偏差累积,瓶颈环节)
3. 直接用“再确认与再测试”
3.1 法规明确建议“先有趋势数据,完成评估后”
中国GMP 确认与验证附录[3]验证状态未发生重大变化设施、设备和工艺等的回顾审核满足再确认或再验证的要求趋势出现渐进性变化评估并采取只有经过系统回顾的数据分析之后,才能评估出去再验证计算机化系统哪一部分功能
3.2上计算机化系统后,数据量指数级增长,依靠人工验证的再验证“验错效率低”
举例来说,目前很多机构设想的备份数据的还原测试方法全年365天一个项目一小时抽样比例大致是0.011%
专业系统电子数据完整性查验方法可参考胡大侠《如何确认数据迁移过程的数据完整性
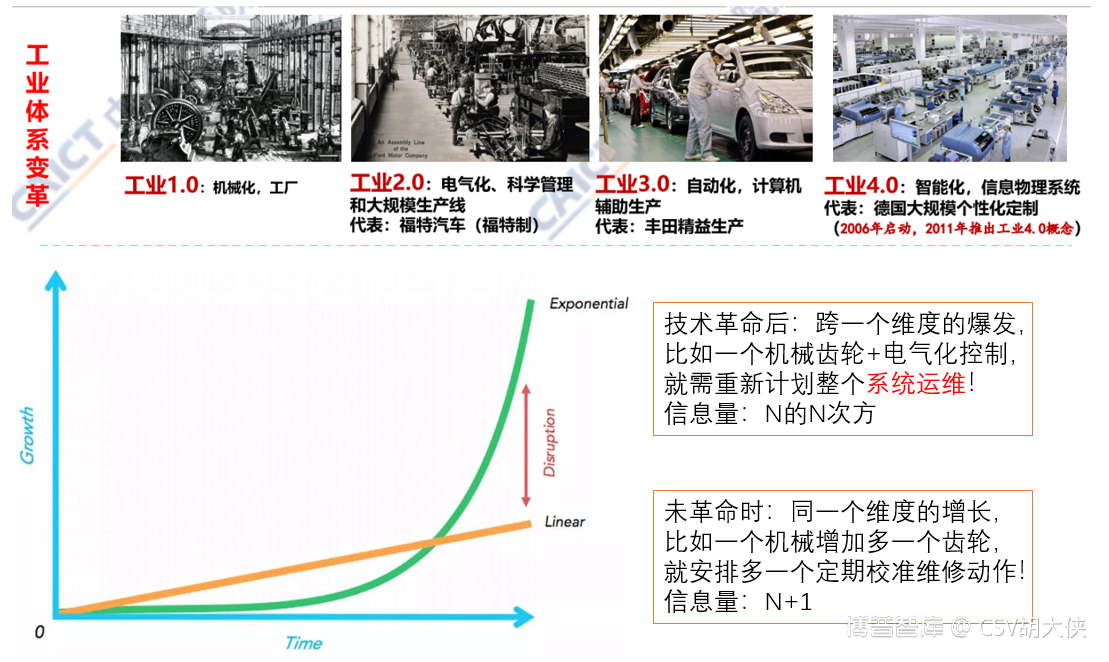
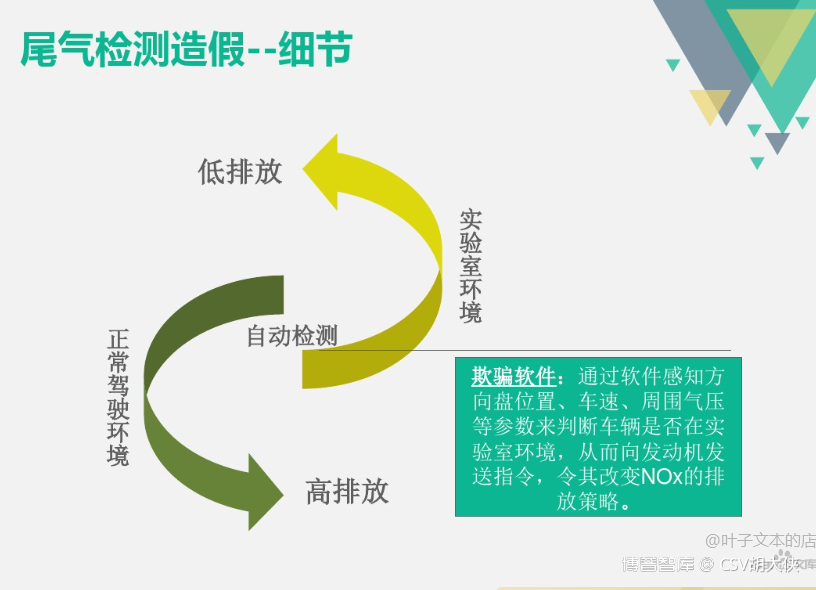
3.3固定的年度再验证方案,计算机化系统更容易伪造和优化结果,起不到质量保障作用
详情可以参考下面《大众汽车尾气年审数据造假的问题
4. 专业IT运维经验:“日常性能监测-》周期性系统回顾-》必要的再验证”
那么先进制造行业数字化与自动化产生的大量设备通讯数据与服务器运维数据应该如何运维,半导体芯片制造行业是如何处理的?大家可以参见2020年 IBM智能制造白皮书 西门子 COMO 工业4.0
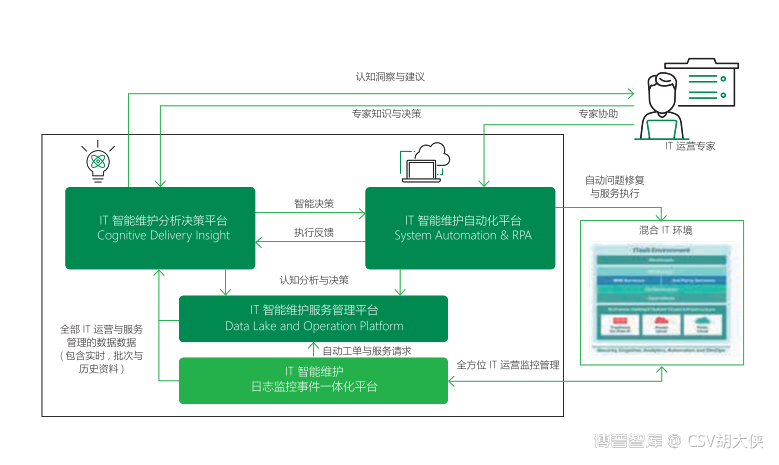
更多阅读
华为公司IT业务手册
Waters-数据持久性 备份还原白皮书
胡大侠 CSV&DI专栏阅读
13.药品追溯码/药械UDI信息化追溯体系-《大侠科普Pharm 4.0》系列 2 -链接
12.“审计追踪功能与回顾” - 欧盟GMP期刊翻译与解读 -链接
11.“Data Availability” - ISPE新指南《数据可靠性源于设计》品鉴4- 链接
10.“DCS 与 SCADA相同与不同” - 《大侠科普Pharm 4.0》系列 1 - 链接
9.“Knowledge Management” - ISPE新指南《数据可靠性源于设计》品鉴3 - 链接
8.“Quality Risk Management” - ISPE新指南《数据可靠性源于设计》品鉴2 - 链接
7.“Foundation of DI by Design”-ISPE新指南《数据可靠性源自设计》品鉴1 - 链接
6.《“透明生产即信任!智能制造是未来?” - 参观汤臣倍健智能工厂随笔》- 链接
5.《备份是CSV必要功能吗? - 从电信号/电子数据/电子记录分析real backup data》 -链接
4.《SOP无可操作性&权限控制混乱 - CSV检查的重灾区》 - 链接
3.《老旧生产系统需补做备份还原测试吗?如何做?》-链接
2. 《CSV的OQ&PQ的相同与不同》-链接
1. 《所有计算机化系统都需要定期备份和定期还原测试吗?》-链接

