一、药品板块
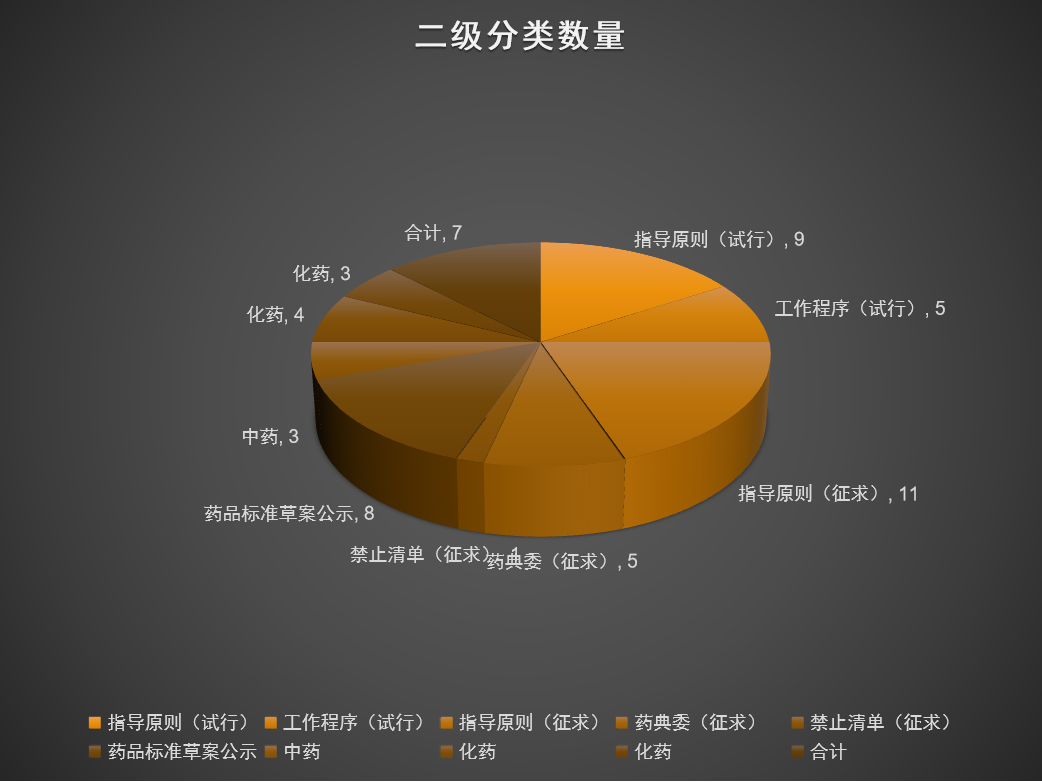


1、文件发布试行
1.1. 2022-11-01 国家发布《儿童用药口感设计与评价的技术指导原则(试行)》:该指导原则主要对儿童用药口感设计与评价的目的和核心评价维度做了介绍,同时也说明了口感设计与常规制剂开发流程的关系,对具体剂型需要评价的内容也做了详细介绍。
1.2. 2022-11-08 国家药监局药审中心关于发布《化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则》的通告: 为了规范和指导化学仿制药口服调释制剂的药学研发,在国家药品监督管理局的部署下,药审中心组织制定了《化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则》。自发布之日起施行。
1.3. 2022-11-08 国家药监局药审中心关于发布《〈已上市化学药品药学变更研究技术指导原则(试行)〉溶出曲线研究的问答》的通告:为规范和指导已上市化学药品药学变更时的溶出曲线研究,提供可参考的技术标准,在国家药品监督管理局的部署下,药审中心组织制定了《〈已上市化学药品药学变更研究技术指导原则(试行)〉溶出曲线研究的问答》。自发布之日起施行。
1.4. 2022-11-11 国家药监局药审中心关于发布《药品注册申请审评期间变更工作程序(试行)》的通知:为配合《药品注册管理办法》的贯彻实施,进一步规范药品注册申请审评期间的变更,保证药品安全、有效和质量可控,药审中心组织制定了《药品注册申请审评期间变更工作程序(试行)》,现予以发布,自发布之日起实施。
1.5. 2022-11-14 国家药监局药审中心关于发布《双特异性抗体抗肿瘤药物临床研发技术指导原则》的通告(2022年第40号):本指导原则主要适用于 BsAb 类抗肿瘤药物,旨在为BsAb 类抗肿瘤药物的临床研发中需要特殊关注的问题提出建议,但是并不针对某一特定类型的 BsAb。靶向于两种抗原表位以上的多特异性抗体类药物研发,也可参考本指导原则。
1.6. 2022-11-16 国家药监局药审中心关于发布《国家药品监督管理局药品审评过程中审评计时中止与恢复管理规范(试行)》的通知:为规范审评过程中审评计时中止和恢复管理,保障药品审评过程合法合规、公平公正,在国家药品监督管理局的统一部署下,药审中心制定了《国家药品监督管理局药品审评过程中审评计时中止与恢复管理规范(试行)》。经国家药品监督管理局审核同意,现予发布,自发布之日起实施。
1.7. 2022-11-25 国家药监局药审中心关于发布 《组织患者参与药物研发的一般考虑 指导原则(试行)》的通告:患者参与到药物研发的全生命周期中,符合以临床价值为导向的药物研发宗旨。为了便于申请人通过组织工作,更好地获得患者的体验信息和数据,在国家药品监督管理局的部署下,药审中心组织制定了《组织患者参与药物研发的一般考虑指导原则(试行)》。现予发布,自发布之日起施行。

1.8. 2022-11-25 国家药监局药审中心关于发布《注射用两性霉素B脂质体生物等效性研究技术指导原则》的通告(2022年第45号): 为不断丰富完善仿制药个药指导原则并持续推进一致性评价工作,进一步指导注射用两性霉素B脂质体生物等效性研究的实施和评价,药审中心组织起草了《注射用两性霉素B脂质体生物等效性研究技术指导原则》。现予发布,自发布之日起施行。


1.9. 2022-11-25 国家药监局药审中心关于发布《他达拉非片生物等效性研究技术指导原则》的通告(2022年第44号):为不断丰富完善仿制药个药指导原则并持续推进一致性评价工作,进一步指导他达拉非片生物等效性研究的实施和评价,药审中心组织起草了《他达拉非片生物等效性研究技术指导原则》。现予发布,自发布之日起施行。

1.10. 2022-11-25 国家药监局药审中心关于发布《氯雷他定片生物等效性研究技术指导原则》的通告(2022年第43号):为不断丰富完善仿制药个药指导原则并持续推进一致性评价工作,进一步指导氯雷他定片生物等效性研究的实施和评价,药审中心组织起草了《氯雷他定片生物等效性研究技术指导原则》。现予发布,自发布之日起施行。

1.11. 2022-11-25 国家药监局药审中心关于发布《富马酸丙酚替诺福韦片生物等效性研究技术指导原则》的通告(2022年第42号): 为不断丰富完善仿制药个药指导原则并持续推进一致性评价工作,进一步指导富马酸丙酚替诺福韦片生物等效性研究的实施和评价,药审中心组织起草了《富马酸丙酚替诺福韦片生物等效性研究技术指导原则》。现予发布,自发布之日起施行。

1.12. 2022-11-30 国家药监局关于实施药品注册申请电子申报的公告(2022年 第110号):
1.13. 2022-11-30 国家药监局关于规范药品网络销售备案和报告工作的公告(2022年 第112号):根据《药品网络销售监督管理办法》的要求,为指导各级药品监督管理部门有序开展药品网络交易第三方平台备案和药品网络销售企业报告工作,现发布相关公告,公告内容包括药品网络交易第三方平台备案【备案资料、材料核对、变更备案、取消备案、数据送达】、药品网络销售企业报告两大内容。
1.14. 2022-11-30 国家药监局关于发布《药品经营质量管理规范附录6:药品零售配送质量管理》的公告(2022年 第113号):为加强药品经营监督管理,进一步规范药品零售配送行为,保障零售配送环节药品质量安全,根据《药品网络销售监督管理办法》和《药品经营质量管理规范》,国家药监局组织制定了《药品经营质量管理规范附录6:药品零售配送质量管理》,现予发布,自2023年1月1日起施行。
2、文件征求意见
2.1. 2022-11-03 国家药监局综合司公开征求《药品网络销售禁止清单(征求意见稿)》意见:为进一步完善药品网络销售监管有关政策,明确药品网络销售范围,国家药监局组织起草了《药品网络销售禁止清单(征求意见稿)》,现公开征求意见。反馈截止时限于2022年11月10日。【此清单已于2022年11月30日正式发布】
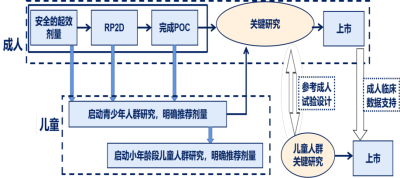
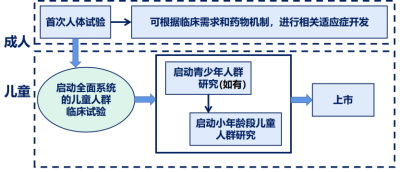
2.2. 2022-11-08 关于公开征求《儿童抗肿瘤药物临床研发技术指导原则》意见的通知:与成人抗肿瘤药物的研发热度相比,儿童抗肿瘤药的研发明显不足。儿童肿瘤治疗领域存在更为迫切的临床需求;同时,相较于成人,儿童抗肿瘤药物研发的难度也更大。为了对儿童抗肿瘤新药的临床研发提供思路和技术建议,药品审评中心组织撰写了《儿童抗肿瘤药物临床研发技术指导原则》,形成征求意见稿,供药物研发的申请人和研究者参考。我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。
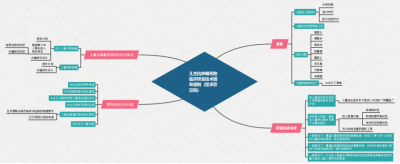
成人儿童共患肿瘤的抗肿瘤药物研发路径
儿童特有肿瘤的抗肿瘤药物研发路径
2.3. 2022-11-08 关于公开征求《新药获益-风险评估技术指导原则》意见的通知:为进一步规范和指导药物临床研发和评价中的获益-风险评估,提供可参考的技术规范,药审中心起草了《新药获益-风险评估技术指导原则》。征求意见时限为自发布之日起1个月。
2.4. 2022-11-16 关于公开征求《狼疮肾炎治疗药物临床试验技术指导原则》意见的通知:本指导原则主要适用于 LN 新药的临床研发,仅作为推荐性建议。主要包括概述;总体考虑;临床药理学研究;探索性临床试验;确证性临床试验:总体设计、对照组、受试者、治疗持续时间、基础治疗、补救治疗、疗效指标;安全性评价等内容。
2.5. 2022-11-16 关于公开征求《慢性肾脏病治疗药物临床试验技术指导原则》意见的通知:指导原则主要讨论了 CKD 治疗药物临床试验设计的总体考虑、研究人群以及疗效终点等重点关注内容。仅作为推荐性建议。主要内容包括:概述及适用范围;总体考虑(受试者、疗效指标);临床药理学研究;探索性临床试验;确证性临床试验(总体设计、受试者、对照药的选择、基础治疗、补救治疗、治疗持续时间、疗效终点);安全性评价;儿科人群临床试验等内容。
2.6. 2022-11-17 关于公开征求《与恶性肿瘤治疗相关中药新药复方制剂临床研发技术指导原则(征求意见稿)》意见的通知:本指导原则在 “三结合”审评证据体系下,侧重阐述中药复方制剂用于恶性肿瘤的临床应用现状、研发原则和方向以及对人用经验研究和临床试验的一般考虑,以期促进与恶性肿瘤治疗相关中药新药复方制剂的研发,并突出中医药治疗的优势和特点。

2.7. 2022-11-18 关于公开征求《干眼治疗药物临床试验技术指导原则(征求意见稿)》意见的通知:本指导原则分为七个章节,分别为概述、临床试验设计的总体考虑、临床药理学研究、探索性临床试验、确证性临床试验、安全性研究和参考文献。
2.8. 2022-11-18 关于公开征求《多发性硬化治疗药物临床试验设计技术指导原则(征求意见稿)》意见的通知:多发性硬化是一种免疫介导的中枢神经系统慢性炎性脱髓鞘性疾病,临床表现、疾病分型、病理生理学过程复杂多样,使多发性硬化治疗药物的临床试验设计和评价面临巨大挑战。为满足多发性硬化治疗药物创新研发的需要,药审中心起草了《多发性硬化治疗药物临床试验设计技术指导原则》,已形成征求意见稿。征求意见时限为自发布之日起1个月。
2.9. 2022-11-18 关于公开征求《特应性皮炎治疗药物临床试验技术指导原则》意见的通知:特应性皮炎是一种慢性、复发性、炎症性皮肤病,同时可合并其他疾病,大多初发于婴儿期,部分患者迁延到成年,严重影响生活质量,目前尚无有效治疗手段。为规范该领域药物的研发与评价,药审中心起草了《特应性皮炎治疗药物临床试验技术指导原则》,已形成征求意见稿。征求意见时限为自发布之日起1个月。
2.10 2022-11-25 关于公开征求《抗肿瘤光动力治疗药物临床研发技术指导原则(征求意见稿)》意见的通知:现阶段国内尚无抗肿瘤光动力治疗药物临床研发相关技术指导原则,现有的指导原则尚不能涵盖和专门针对抗肿瘤光动力治疗药物的临床试验设计的考虑,为进一步明确技术原则,提高新药研发效率,化药临床一部相关适应症小组组织撰写了《抗肿瘤光动力治疗药物临床研发技术指导原则》,形成征求意见稿,。征求意见时限为自发布之日起1个月。

2.11. 2022-11-28 关于公开征求ICH指导原则《Q5A(R2):来源于人或动物细胞系生物技术产品的病毒安全性评价》意见的通知:ICH指导原则《Q5A(R2):来源于人或动物细胞系生物技术产品的病毒安全性评价》现进入第3阶段征求意见。按照ICH相关章程要求,ICH监管机构成员需收集本地区关于第2b阶段指导原则初稿的意见并反馈ICH。Q5A(R2)原文和中文译文见附件,现就该指导原则内容及中文译文翻译稿向社会公开征求意见。社会各界如有意见,请于2023年1月20日前通过电子邮箱反馈我中心。
2.12. 2022-11-21 药委拟制定药包材生物学评价与试验选择指导原则,为确保标准的科学性、合理性和适用性,现将拟制定的标准公示征求社会各界意见。公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。
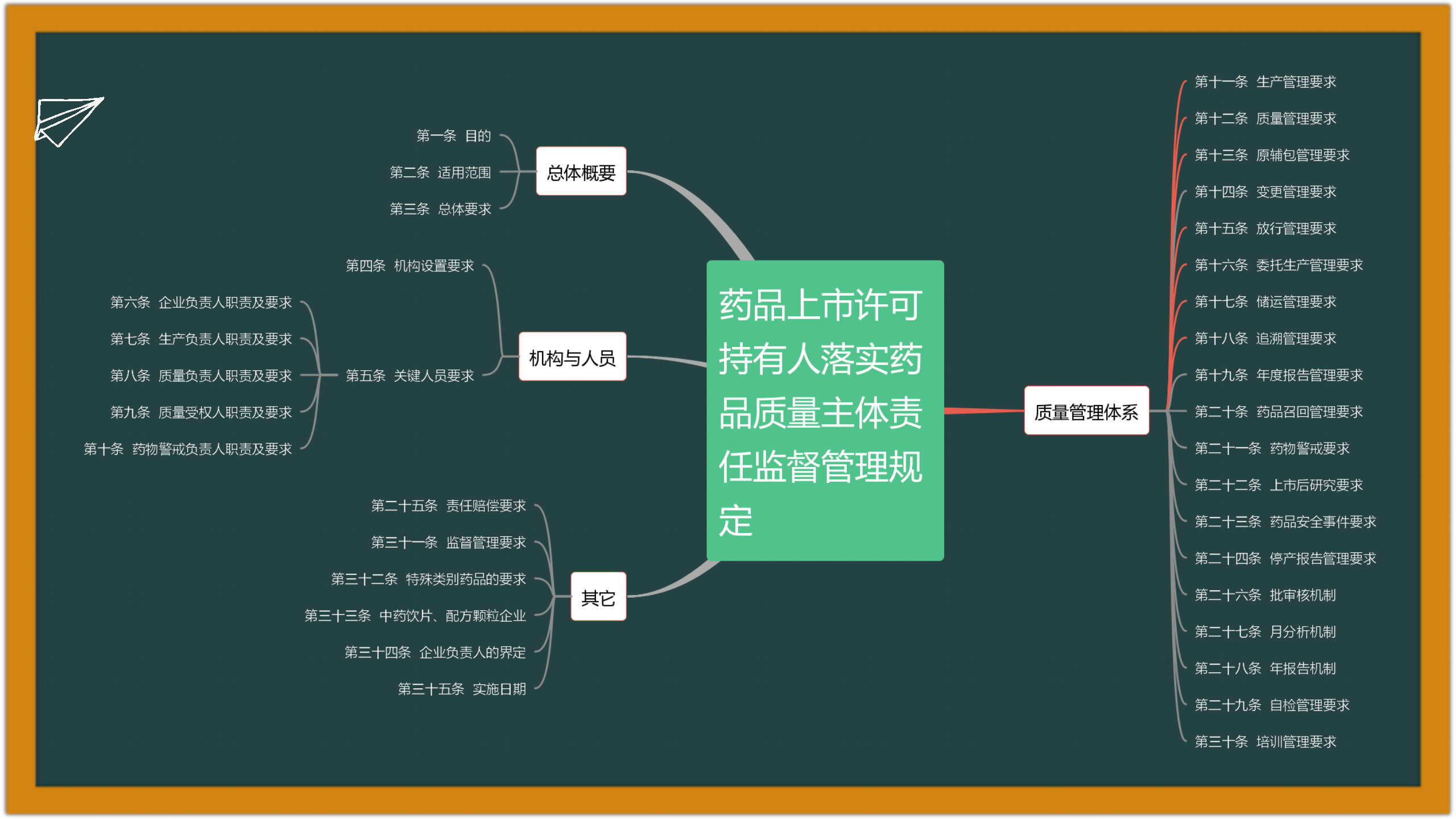
2.13. 2022-11-29 国家药监局综合司公开征求《药品上市许可持有人落实药品质量主体责任监督管理规定(征求意见稿)》意见:为督促药品上市许可持有人落实药品质量主体责任,进一步加强药品全生命周期质量监督管理,国家药监局组织起草了《药品上市许可持有人落实药品质量主体责任监督管理规定(征求意见稿)》,现向社会公开征求意见。请于2022年12月9日前,将有关意见反馈至电子邮件yaopinjianguan-2@nmpa.gov.cn,邮件标题请注明“落实持有人主体责任管理规定意见反馈”。
2.13. 2022-11-29 药典委拟制定洋葱伯克霍尔德菌群检查法:为确保标准的科学性、合理性和适用性,现将拟制定标准公示征求社会各界意见,公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱。
2.14. 2022-11-29 药典委拟修订9201药品微生物检验替代方法验证指导原则:为确保标准的科学性、合理性和适用性,现将拟制定标准公示征求社会各界意见(详见附件)。公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱。
2.15. 2022-11-29 经第十二届药典委员会相关专业委员会审核,对世界卫生组织国际非专利名称(INN)建议目录127(P-List-127)的中文通用名称予以确定,以及对以往目录中已收录的个别中文通用名称进行修正。为确保上述通用名称的准确性、合理性和唯一性,现公示征求社会各界意见(详见附件)。公示期自发布之日起一个月。请相关单位认真研核,若有异议,请及时来函提交反馈意见,并附相关说明和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱。
2.16. 2022-11-29 药典委拟制定微生物全基因组测序技术指导原则:为确保标准的科学性、合理性和适用性,现将拟制定标准公示征求社会各界意见(详见附件)。公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱。
3、标准草案公示
3.1. 2022-11-18日,药典委拟修订肾炎舒胶囊【WS3-136(Z-136)-2002Z】、康寿丸【WS3-B-2231-96】、通脉降脂片、通脉降脂胶囊【WS-10472(ZD-0472)-2002-2011Z】四个品种的国家药品标准,为确保标准的科学性、合理性和适用性,现将拟修订国家药品标准公示征求社会各界意见。公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱。
3.2. 2022-11-21 药典委拟修订哮喘片国家药品标准,为确保标准的科学性、合理性和适用性,现将拟修订的哮喘片国家药品标准公示征求社会各界意见。公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。
3.3. 2022-11-21 药委拟修订人工牛黄国家药品标准,标准编号:《中国药典》2020年版一部。为确保标准的科学性、合理性和适用性,现将拟修订的人工牛黄国家药品标准公示征求社会各界意见。公示期自发布之日起三个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。
3.4. 2022-11-29 药典委拟修订羟苯磺酸钙国家药品标准:标准编号:《中国药典》2020年版二部。为确保标准的科学性、合理性和适用性,现将拟修订的羟苯磺酸钙国家药品标准公示征求社会各界意见(第二次)。公示期自发布之日起14天。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱。
3.5. 2022-11-29 药典委拟修订尼群地平国家药品标准:标准编号:《中国药典》2020年版二部。为确保标准的科学性、合理性和适用性,现将拟修订的尼群地平国家药品标准公示征求社会各界意见(详见附件)。公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱。
4、说明书修订
4.1. 2022-11-01 根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对注射用黄芪多糖、灯盏花素氯化钠注射液和板蓝根注射液说明书中的警示语及【不良反应】、【禁忌】和【注意事项】项进行统一修订
4.2. 2022-11-02 根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对阿仑膦酸钠制剂(包括阿仑膦酸钠片、阿仑膦酸钠肠溶片、阿仑膦酸钠维D3片和阿仑膦酸钠维D3片(Ⅱ))说明书内容进行统一修订
4.3. 2022-11-02 根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对肝水解肽注射剂(包括肝水解肽注射液和注射用肝水解肽)说明书内容进行统一修订
4.4. 2022-11-04 根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对甲氨蝶呤口服制剂说明书内容进行统一修订。
4.5. 2022-11-11 根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对间苯三酚注射剂(包括间苯三酚注射液、注射用间苯三酚)说明书内容进行统一修订。
5、产品上市
5.1. 2022-11-03 国家药监局批准盐酸托鲁地文拉法辛缓释片上市:国家药品监督管理局批准山东绿叶制药有限公司申报的1类创新药盐酸托鲁地文拉法辛缓释片(商品名:若欣林)上市。该药为我国自主研发并拥有自主知识产权的创新药,适用于抑郁症的治疗。
5.2. 2022-11-09 国家药监局附条件批准林普利塞片上市:近日,国家药品监督管理局通过优先审评审批程序附条件批准上海璎黎药业有限公司申报的1类创新药林普利塞片(商品名:因他瑞)上市。该药为我国自主研发并拥有自主知识产权的创新药,适用于既往接受过至少两种系统性治疗的复发或难治滤泡性淋巴瘤成人患者。林普利塞为磷脂酰肌醇-3-激酶的δ亚型(PI3Kδ)选择性抑制剂。林普利塞片可抑制PI3Kδ蛋白的表达,降低AKT蛋白磷酸化水平,从而诱导细胞凋亡以及抑制恶性B细胞和原发肿瘤细胞的增殖。该药品的上市为经现有治疗手段治疗后复发难治的滤泡淋巴瘤成人患者提供了治疗选择。
5.3. 2022-11-18 国家药品监督管理局批准氯巴占片上市:国家药品监督管理局通过优先审评审批程序批准宜昌人福药业有限责任公司申报的化学仿制药品氯巴占片上市,批准适应症为用于2岁及以上Lennox-Gastaut综合征(LGS)患者癫痫发作的联合治疗。
6、其它
6.1. 2022-11-07 国家药监局召开中药管理战略决策专家咨询委员会会议:11月3日,国家药监局在京召开中药管理战略决策专家咨询委员会(以下简称决咨委)会议,贯彻落实党的二十大精神,针对促进中药传承创新发展、加强中药全链条监管及近期重点工作,广泛深入听取委员们意见建议,为中药科学监管汇智聚力。会议由决咨委主任委员孙咸泽主持,国家药监局副局长赵军宁出席会议并讲话。
6.2. 2022-11-10 关于举办《ICH S系列指导原则线上培训》的通知:为进一步提升国内监管机构和业界对ICH安全性指导原则的理解与掌握,加大宣传培训力度,国家药品监督管理局ICH工作办公室将于2022年11月17日开展《ICH S系列指导原则线上培训》,主要围绕3个S系列指导原则进行解读。
6.3. 2022-11-22 国家药监局综合司 海关总署办公厅关于增设石家庄航空口岸为药品进口口岸有关事宜的通知:经国务院批准,同意增设石家庄航空口岸为药品进口口岸。
6.4. 2022-11-15 国家药监局关于19批次药品不符合规定的通告(2022年第55号): 经辽宁省药品检验检测院等3家药品检验机构检验,标示为洛阳顺势药业有限公司等12家企业生产的接骨七厘丸等19批次药品不符合规定。现将相关情况通告如下:

6.5. 2022-11-23 关于国家药品监督管理局行政受理服务大厅临时调整服务方式的公告:当前,北京市疫情形势严峻复杂。为有效控制和降低疫情传播风险,最大限度减少人员流动、聚集,切实保障行政相对人身体健康,经研究,决定自2022年11月24日(周四)起,国家药品监督管理局行政受理服务大厅药品、医疗器械、化妆品等行政许可业务现场办理调整为通过网上或邮寄申报资料形式办理,线下咨询服务调整为通过网络、电话、信函进行咨询。现场服务恢复时间另行通知。行政受理服务咨询电话010-88331866。
6.6. 2022-11-23 国家局公示天津中新药业集团股份有限公司乐仁堂制药厂的通脉养心丸保护受理。
6.7. 2022-11-24 国家局公示朗致集团双人药业有限公司的枳术宽中胶囊保护受理
6.8. 2022-11-28 关于药审中心与中国药品监督管理研究会合作举办“新药非临床研究技术指导原则”线上培训的通知:为进一步指导我国新药研发,加快新药研发上市进程,加强与非临床机构、研发企业的沟通交流,提升我国新药研发水平和效率,药审中心定于2022年12月8日举办“新药非临床研究技术指导原则”线上培训。
二、器械板块
1、标准品说明书公示
1.1. 2022-11-01 关于孕酮冰冻人血清国家标准品说明书公示的通知:中检院已完成孕酮冰冻人血清国家标准品的研制,现就说明书内容向社会公示并征求意见。请于2022年11月8日前将意见反馈至中检院体外诊断试剂所。
1.2. 2022-11-17 关于高通量测序用外周血胎儿染色体拷贝数变异国家参考品说明书公示的通知:我院已完成高通量测序用外周血胎儿染色体拷贝数变异国家参考品的研制,现就说明书内容向社会公示并征求意见。请于2022年11月23日前将意见反馈至中检院体外诊断试剂检定所。
1.3. 2022-11-18 关于单纯疱疹病毒1+2型核酸检测试剂国家参考品说明书公示的通知:我单位已完成单纯疱疹病毒1+2型检测试剂国家参考品的研制,现就说明书内容向社会公示并征求意见。请于2022年11月28日前将意见反馈至中检院诊断试剂所。
2、文件发布
2022-11-01 国家药监局关于发布《医疗器械经营质量管理规范附录:专门提供医疗器械运输贮存服务的 企业质量管理》:《附录》从质量管理体系建立与改进、机构与人员、设施与设备、计算机信息系统以及质量责任等方面,对专门提供医疗器械运输、贮存服务的企业提出具体要求。在保障医疗器械质量安全、风险可控的基础上,《附录》鼓励企业充分利用现代物流行业信息化、数字化与互联网、物联网等新技术,推动医疗器械唯一标识的落地实施,推进医疗器械全程可追溯。鼓励企业集约化、一体化、数字化发展,采用新技术发展现代物流,提升医疗器械供应保障服务能力。《附录》自2023年1月1日起施行。
2022-11-29 国家药监局综合司公开征求《企业落实医疗器械质量安全主体责任监督管理规定(征求意见稿)》意见:为督促医疗器械注册人、备案人落实医疗器械质量安全主体责任,强化医疗器械注册人、备案人、受托生产企业及经营企业质量安全关键岗位人员责任落实,国家药监局组织起草了《企业落实医疗器械质量安全主体责任监督管理规定(征求意见稿)》(见附件),现向社会公开征求意见。请于2022年12月9日前将有关意见反馈至电子邮箱zjfdaqxc@163.com。
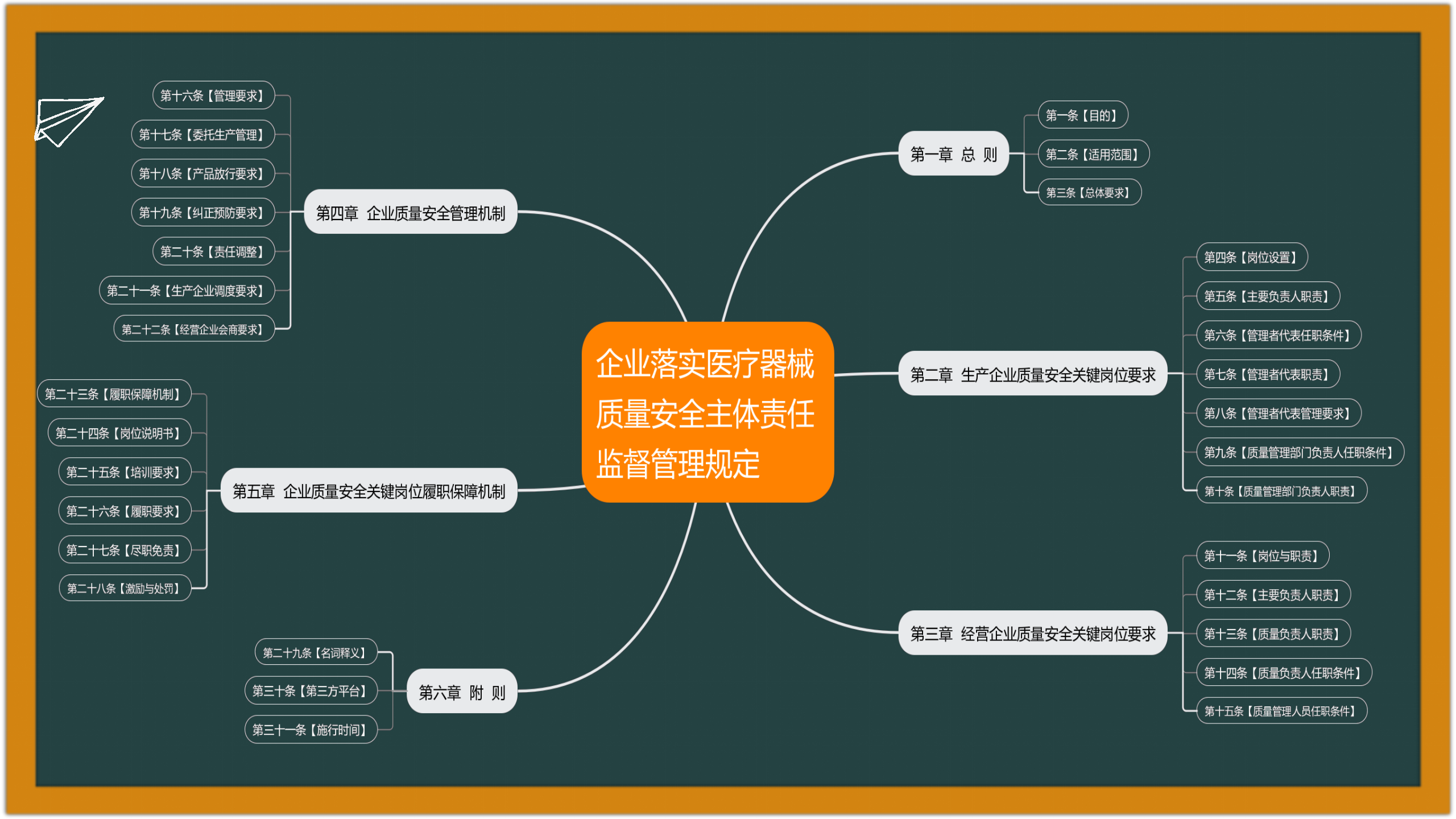
2022-11-30 国家药监局综合司公开征求《关于做好第三批实施医疗器械唯一标识工作的公告(征求意见稿)》意见:为进一步贯彻落实《医疗器械监督管理条例》《国务院办公厅关于印发治理高值医用耗材改革方案的通知》和国务院深化医药卫生体制改革有关重点工作任务,推进医疗器械唯一标识在监管、医疗、医保等领域的衔接应用,国家药监局组织起草了《关于做好第三批实施医疗器械唯一标识工作的公告(征求意见稿)》,现公开征求意见。请将修改意见和建议于2022年12月30日前反馈至电子邮箱:mdct@nmpa.gov.cn,邮件标题注明“UDI第三批实施”。
3、产品上市
2022-11-17 人工血管获批上市:近日,国家药品监督管理局经审查,批准了江苏百优达生命科技有限公司生产的创新产品“人工血管”注册。人工血管主要由PET线编织制成,涂覆有牛胶原蛋白和甘油。该产品的聚酯编织采用创新编制工艺,外层经纱采用弹性纱线(涤纶低弹丝DTY纱线),中间层采用非弹性纱线(涤纶全牵伸FDY纱线),纬纱采用弹性纱线、非弹性纱线组成的复合纱线。该编制工艺使织物具有更小且更均匀的孔隙,预期将改进成品的渗血性能。人工血管用于主动脉及其分支血管的置换或旁路手术。该产品的上市将为临床治疗提供更多选择。
4、产品注销
2022-11-17 国家药监局关于注销医疗器械注册证书的公告:按照《医疗器械监督管理条例》的规定,根据企业申请,现注销安徽养和医疗器械设备有限公司半导体激光治疗系统的医疗器械注册证,注册证编号:国械注准20163091004。

