MAH在推进药品全生命周期的活动中,对委托生产的药品,要求受托企业要按CDE批准的生产工艺来进行生产。同时生产过程也要符合GMP要求。产品也要符合国家标准。生产过程也要有厂地管理文件并持续保持更新。定期汇报药品年度报告、上市后的研究以及风险管理的措施。
MAH要建立MAH质量管理框架,从质量管理药物警戒两个领域实现MAH的质量管理,同时因为MAH有可是委托研发做临床研究,也可以委托生产做生产工艺的开发和产品的商业化生产,同时也可以委托经销商去进行销售,所在在整个药品的生命周期中,MAH需要和受托企业建立质量管理联合委员会,制定服务协议和质量协议,通过联全质量管理机制来定期的审核质量协议的要求执行情况,有无异常情况需要改进,在合作开展之前,MAH需要对受托企业进行资质确认,进行质量审计,审计可以是基于风险的策略,根据受托企业实际提供的质量来进行不同频率的风险审计。在这样的模式下可以确保产品开发研究、生产、销售渠道持续的合规。
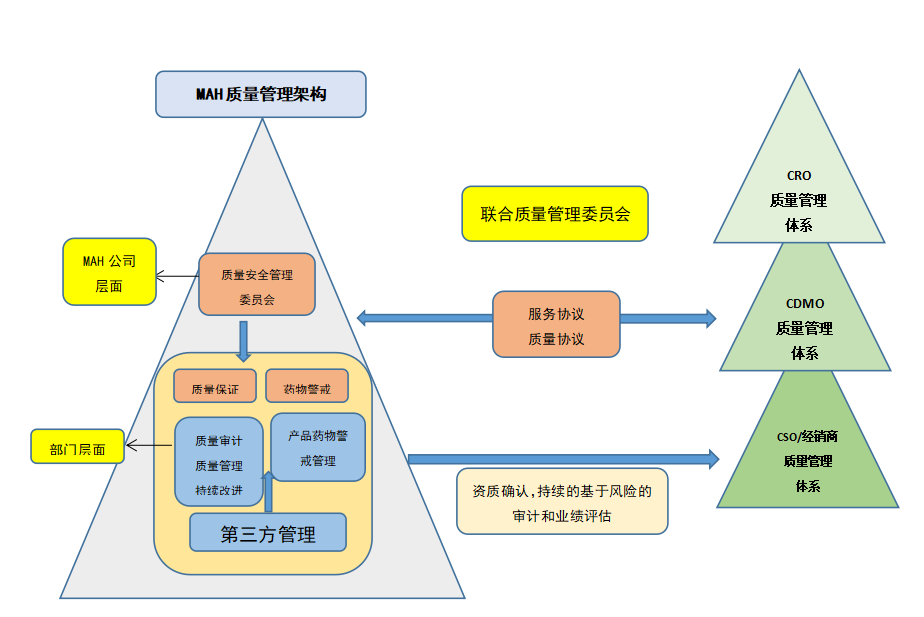
质量监管模式基于高级管理层参与,否则可能会流于形式,或者执行受阻,没有力度。包括质量保证部门、PV部门,MAH质量与药物安全委员会,跨公司的联合质量管理委员会对质量绩效、质量问题的风险进行联合管理。
MAH质量体系主要流程包括三大部分
第一是关于质量管理体系的要素和流程,例如质量管理架构和职责,质量管理审评规程及质量计划的制定,危机管理、风险管理的流程。文件管理体系,文件不仅要考虑到MAH自有的文件,还要有与CDMO/CRO/CSO对接的文件体系,还有关于培训体系的要求。这是从管理体系的几个大的流程。同时在的受托企业进行合作的时候要建立第三方审计的流程和体系并定期进行审计确认资质。关键的文件资料要双方签字批准。
第二质量管理的流程,比如说受托企业的偏差、变更、OOS、OOT、投诉等的管理和处理流程。如果MAH认为受托业的管理流程适用于受托产品,可以直接用,也可以重新约定,比如对于偏差的报告,可能要求中等以上的偏差要报告MAH,就不需要所有的偏差都报告。变更也是同样。另外也需要建立药物警戒的流程,包括不良反应的监测,对于生产企业还需要和受托企业建立印刷包材管理流程。生产企业还需建立产品放行规程,明确和CMO之间的放行流程和职责。受托企业负责生产放行,MAH负责最终的上市放行。最终的上市放行必须要满足注册要求和注册标准。MAH要建立药物警戒监测体系,包括及时报告不良反应,报告后进行一些事件的评价及数据的监控。建立风险控制措施,安全性研究。
第三产品上市放行后还会有一些上市后的管理流程,比如产品召回流程,为确保召回体系的有效性要进行模拟召回,这期间要明确怎么和监管机构汇报,考虑危机处理应急预案。在新的药品生产管理办法里一直在强调产品档案信息的维护,这个产品档案信息是由企业提供信息同时监管机构从它的数据里查看产品的安全信息、不良反应监测情况、注册备案信息,来判定这个产品质量。对于年报制度就会涉及注册与再注册、药物警戒和产品质量年度回顾信息。在产品上市后会有一个产品追溯和经销商管理流程。
MAH有职责进行受托企业的生产全过程的管理,管理的方式有多种,包括定期审计,也可以在生产过程中派人驻厂监督,特别是对于一些关键工艺步骤,现场监控。GMO所有的生产活动要符合GMP的要求。对于一些操作规程、工艺规程、质量标准等,MAH有必要去审核批准,确保受托企业能够正确的实施。签订质量协议需明确MAH和CMO的责任,在对关键生产检测和职责进行明确规定。并建立沟能通机制。质量协议包括但不限于以下(目前国家局也颂布了模板),目的范围,分岐解决机制、生产活动、质量协议的生产周期和修订方法,GMP要求等。

