药品板块
一、征求指导原则
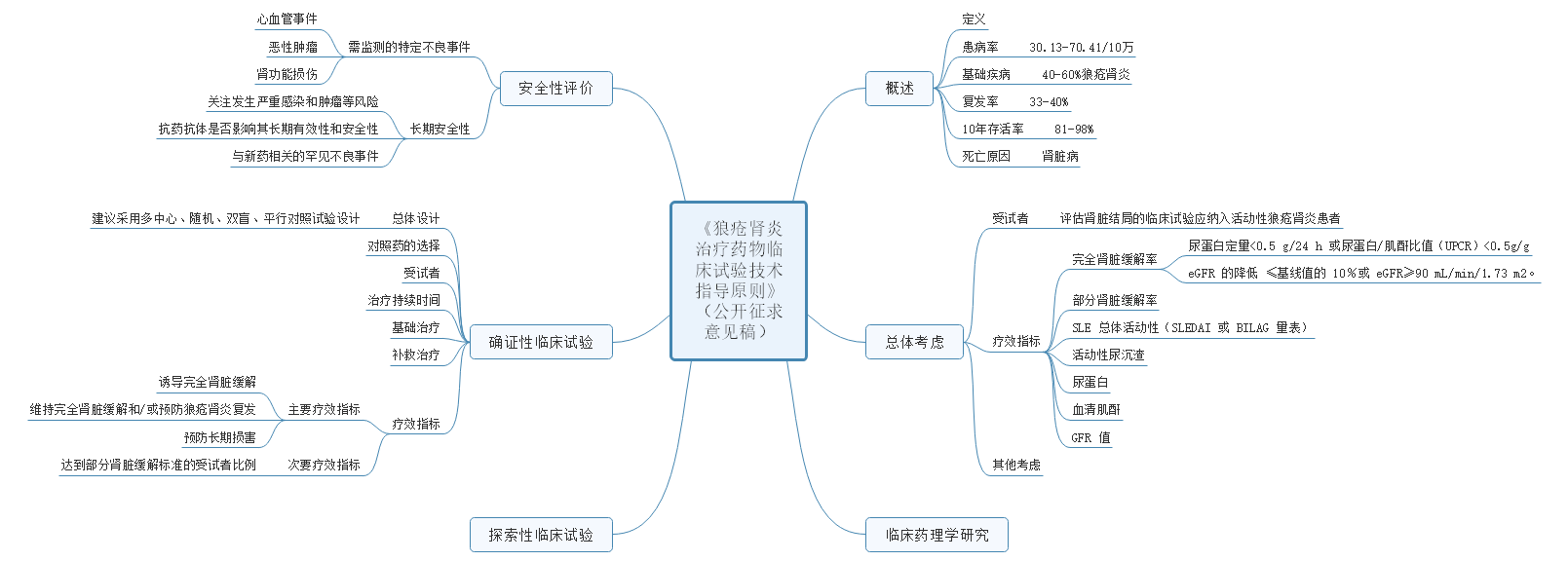
1、关于公开征求《狼疮肾炎治疗药物临床试验技术指导原则》意见的通知
狼疮肾炎(lupus nephritis,LN)是系统性红斑狼疮(systemic lupus erythematosus,SLE)引起的肾脏损害。
本指导原则主要适用于 LN 新药的临床研发,仅作为推荐性建议。主要包括概述;总体考虑;临床药理学研究;探索性临床试验;确证性临床试验:总体设计、对照组、受试者、治疗持续时间、基础治疗、补救治疗、疗效指标;安全性评价等内容。
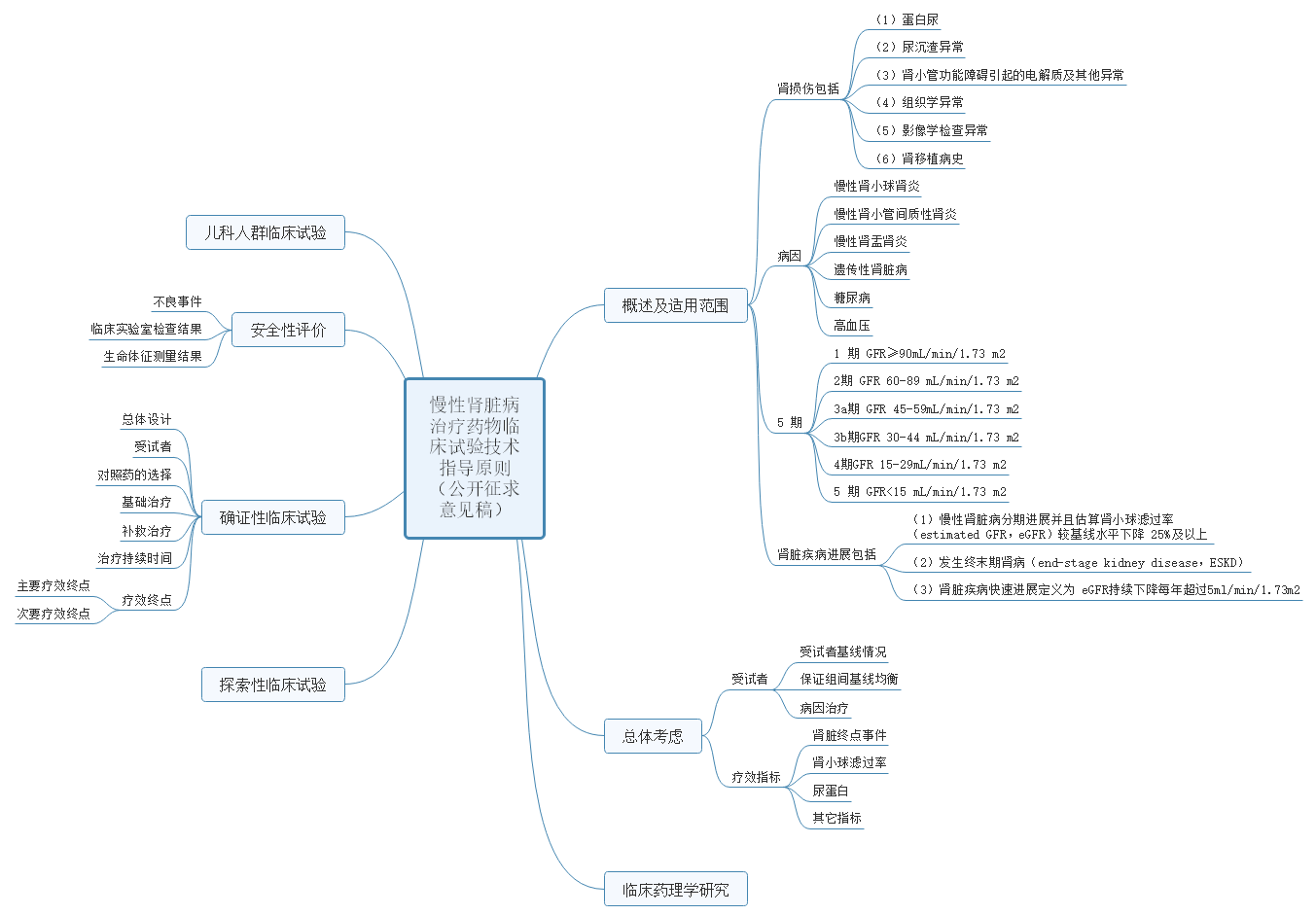
2、关于公开征求《慢性肾脏病治疗药物临床试验技术指导原则》意见的通知
慢性肾脏病(Chronic kidney disease,CKD)为肾脏结构或功能异常持续 3 个月以上,并对健康造成影响的一类疾病。
指导原则主要讨论了 CKD 治疗药物临床试验设计的总体考虑、研究人群以及疗效终点等重点关注内容。仅作为推荐性建议。主要内容包括:概述及适用范围;总体考虑(受试者、疗效指标);临床药理学研究;探索性临床试验;确证性临床试验(总体设计、受试者、对照药的选择、基础治疗、补救治疗、治疗持续时间、疗效终点);安全性评价;儿科人群临床试验等内容。
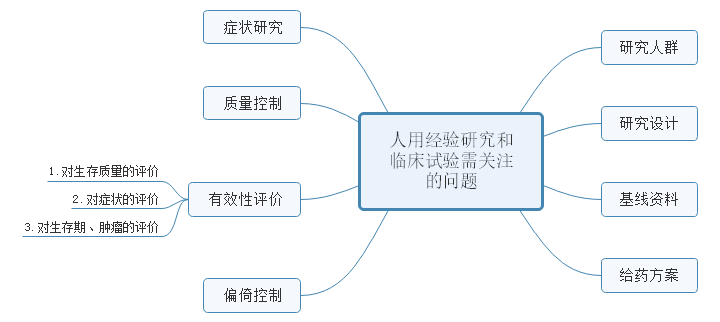
3、关于公开征求《与恶性肿瘤治疗相关中药新药复方制剂临床研发技术指导原则(征求意见稿)》意见的通知
本指导原则在 “三结合”审评证据体系下,侧重阐述中药复方制剂用于恶性肿瘤的临床应用现状、研发原则和方向以及对人用经验研究和临床试验的一般考虑,以期促进与恶性肿瘤治疗相关中药新药复方制剂的研发,并突出中医药治疗的优势和特点。
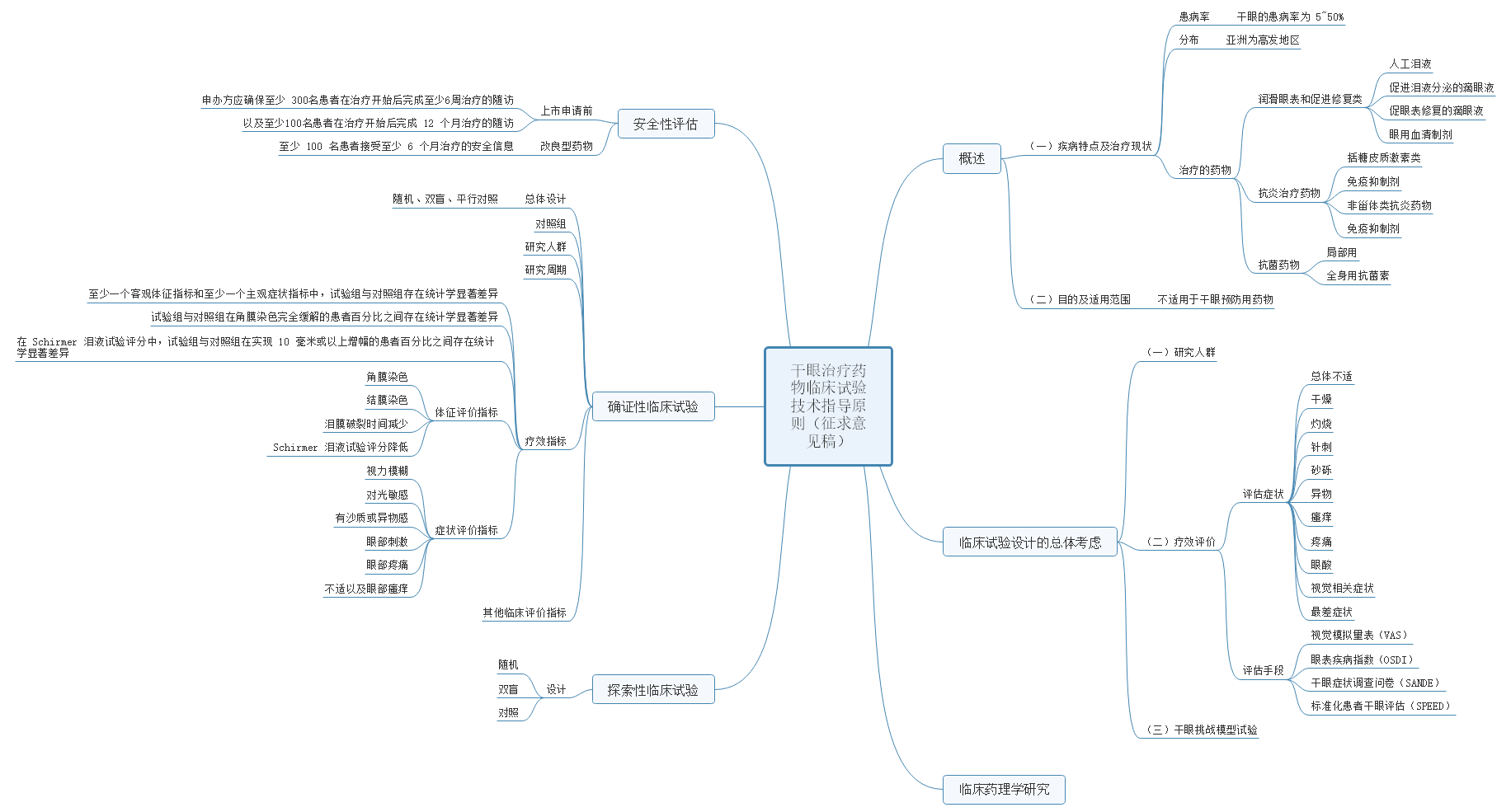
4、关于公开征求《干眼治疗药物临床试验技术指导原则(征求意见稿)》意见的通知
干眼是一种多因素引起的慢性眼表疾病,患病率高、严重影响患者视觉与生活质量、尚缺乏有效治疗手段。由于目前该病诊断和分类标准尚不统一、多因素影响疾病特征和进程、疾病症状和体征分离、患者感受和疾病状态检测的内在变异性等,使干眼治疗药物的临床试验设计和评价面临巨大挑战。为满足干眼治疗药物创新研发的需要,药审中心起草了《干眼治疗药物临床试验技术指导原则》,已形成征求意见稿。征求意见时限为自发布之日起1个月。
本指导原则分为七个章节,分别为概述、临床试验设计的总体考虑、临床药理学研究、探索性临床试验、确证性临床试验、安全性研究和参考文献。
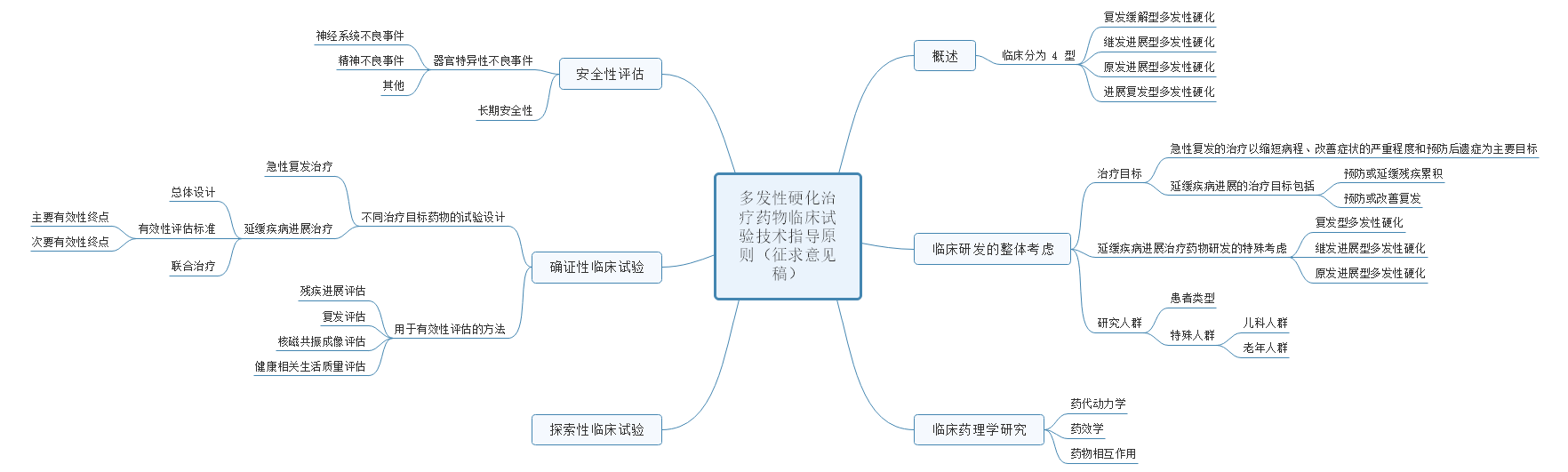
5、关于公开征求《多发性硬化治疗药物临床试验设计技术指导原则(征求意见稿)》意见的通知
多发性硬化是一种免疫介导的中枢神经系统慢性炎性脱髓鞘性疾病,临床表现、疾病分型、病理生理学过程复杂多样,使多发性硬化治疗药物的临床试验设计和评价面临巨大挑战。为满足多发性硬化治疗药物创新研发的需要,药审中心起草了《多发性硬化治疗药物临床试验设计技术指导原则》,已形成征求意见稿。征求意见时限为自发布之日起1个月。
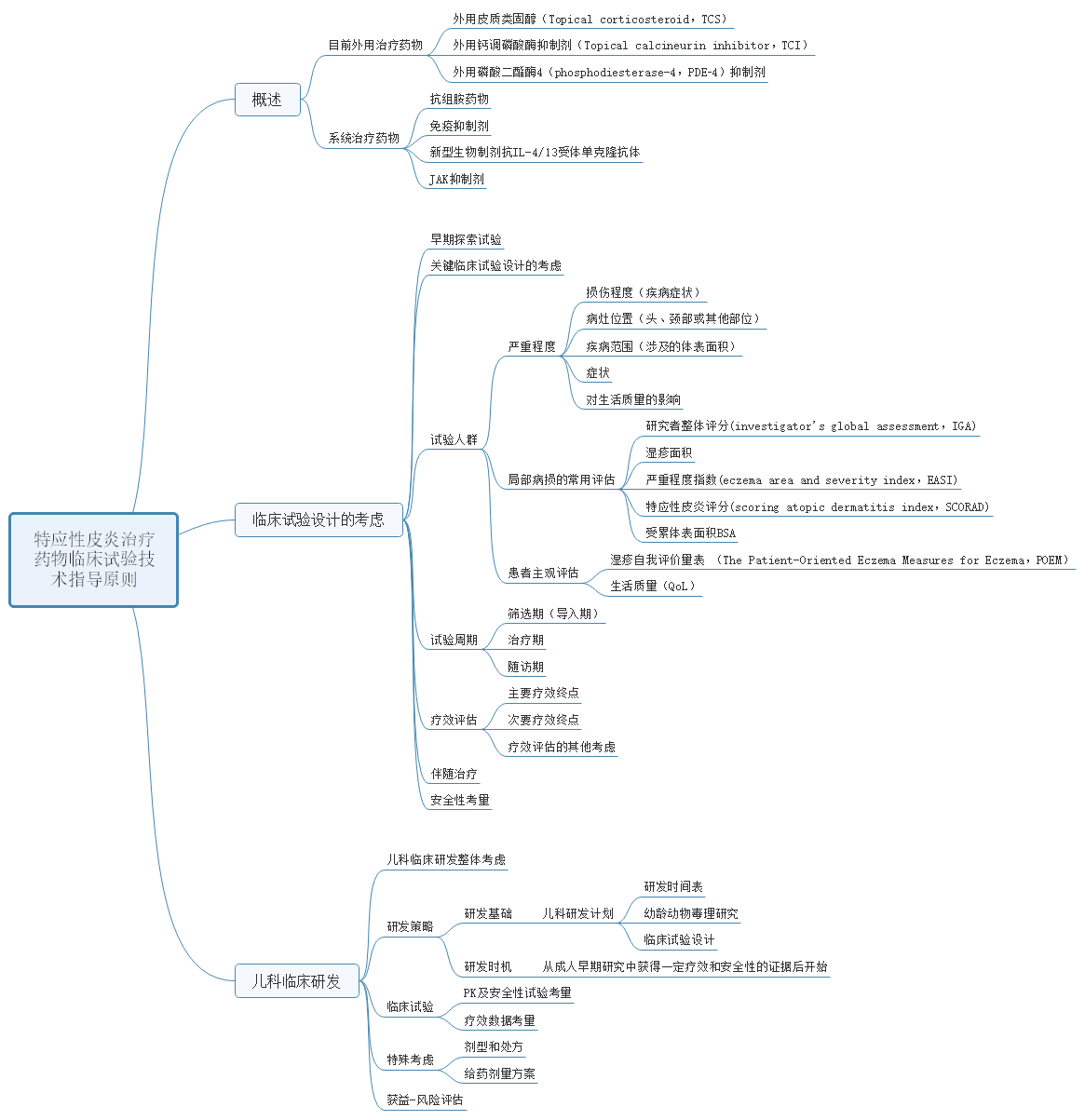
6、关于公开征求《特应性皮炎治疗药物临床试验技术指导原则》意见的通知
特应性皮炎是一种慢性、复发性、炎症性皮肤病,同时可合并其他疾病,大多初发于婴儿期,部分患者迁延到成年,严重影响生活质量,目前尚无有效治疗手段。为规范该领域药物的研发与评价,药审中心起草了《特应性皮炎治疗药物临床试验技术指导原则》,已形成征求意见稿。征求意见时限为自发布之日起1个月。
二、文件发布实施
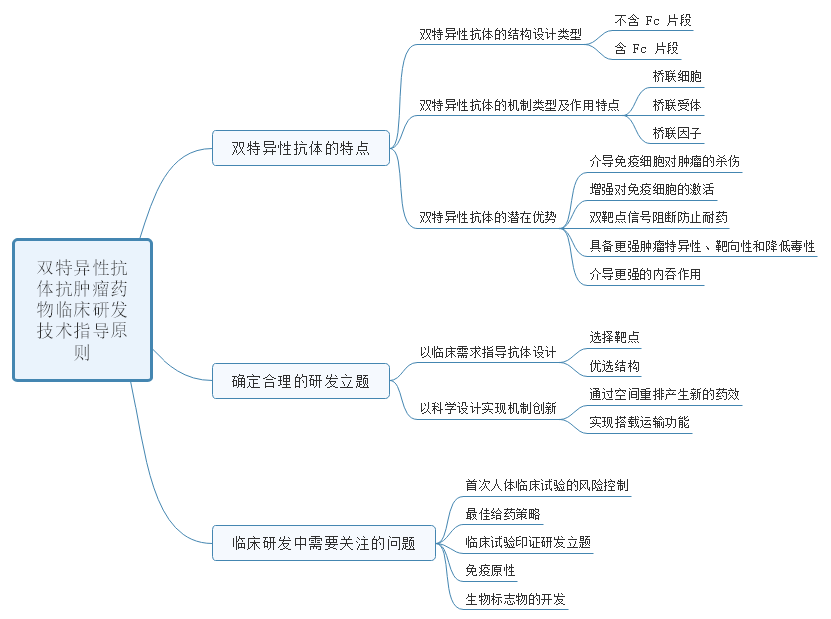
1、国家药监局药审中心关于发布《双特异性抗体抗肿瘤药物临床研发技术指导原则》的通告(2022年第40号)
近年来,随着多个 BsAb 类药物的成功上市,引发了医药界对 BsAb 类药物的研发热情;生物制药技术的发展,进一步推动 BsAb 类药物进入高速发展阶段,尤其是在肿瘤治疗领域,BsAb 药物研发呈现持续增长。此外抗体类型也已经不限于 BsAb 类,已有 “三特异性抗体(tri-specificantibody)”、“四特异性抗体(tetra-specific antibody)”等同时靶向多种抗原表位的 “多特异性抗体类(multi-specificantibody)”药物进入临床研发阶段。
本指导原则主要适用于 BsAb 类抗肿瘤药物,旨在为BsAb 类抗肿瘤药物的临床研发中需要特殊关注的问题提出建议,但是并不针对某一特定类型的 BsAb。靶向于两种抗原表位以上的多特异性抗体类药物研发,也可参考本指导原则。
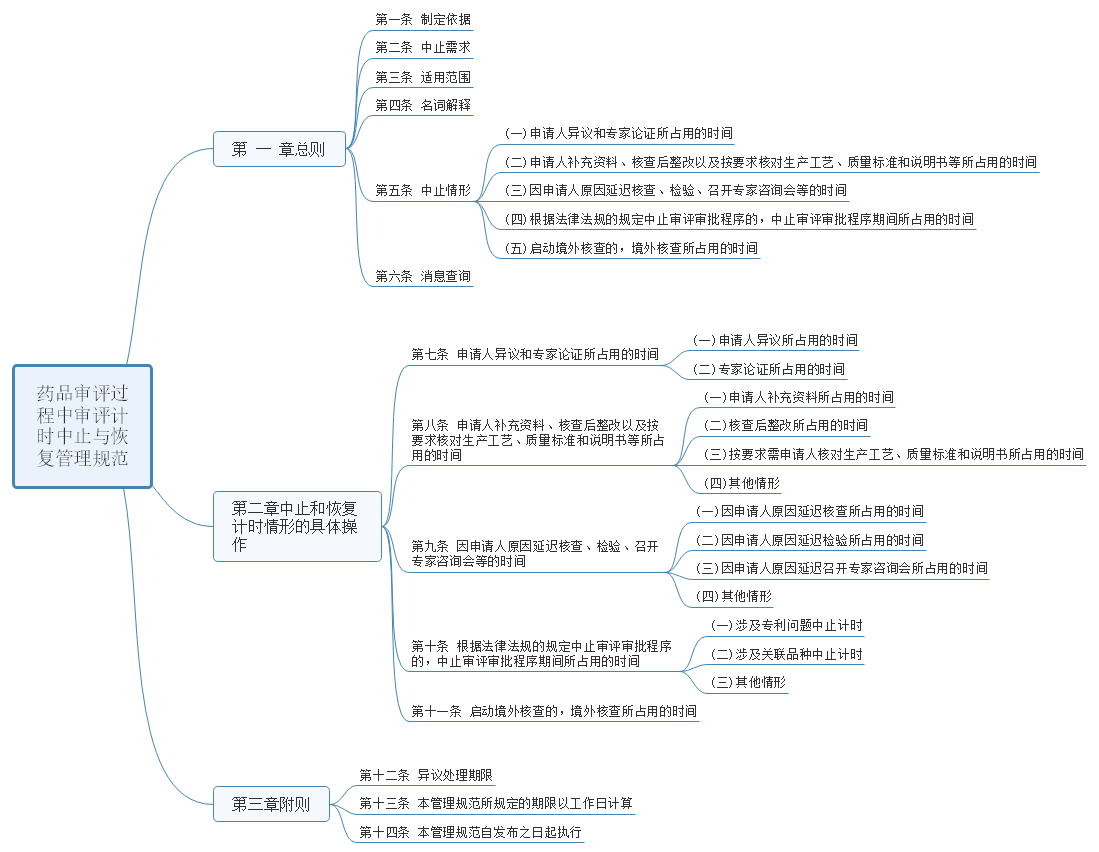
2、国家药监局药审中心关于发布《国家药品监督管理局药品审评过程中审评计时中止与恢复管理规范(试行)》的通知
为规范审评过程中审评计时中止和恢复管理,保障药品审评过程合法合规、公平公正,在国家药品监督管理局的统一部署下,药审中心制定了《国家药品监督管理局药品审评过程中审评计时中止与恢复管理规范(试行)》。经国家药品监督管理局审核同意,现予发布,自发布之日起实施。
三、检查通告
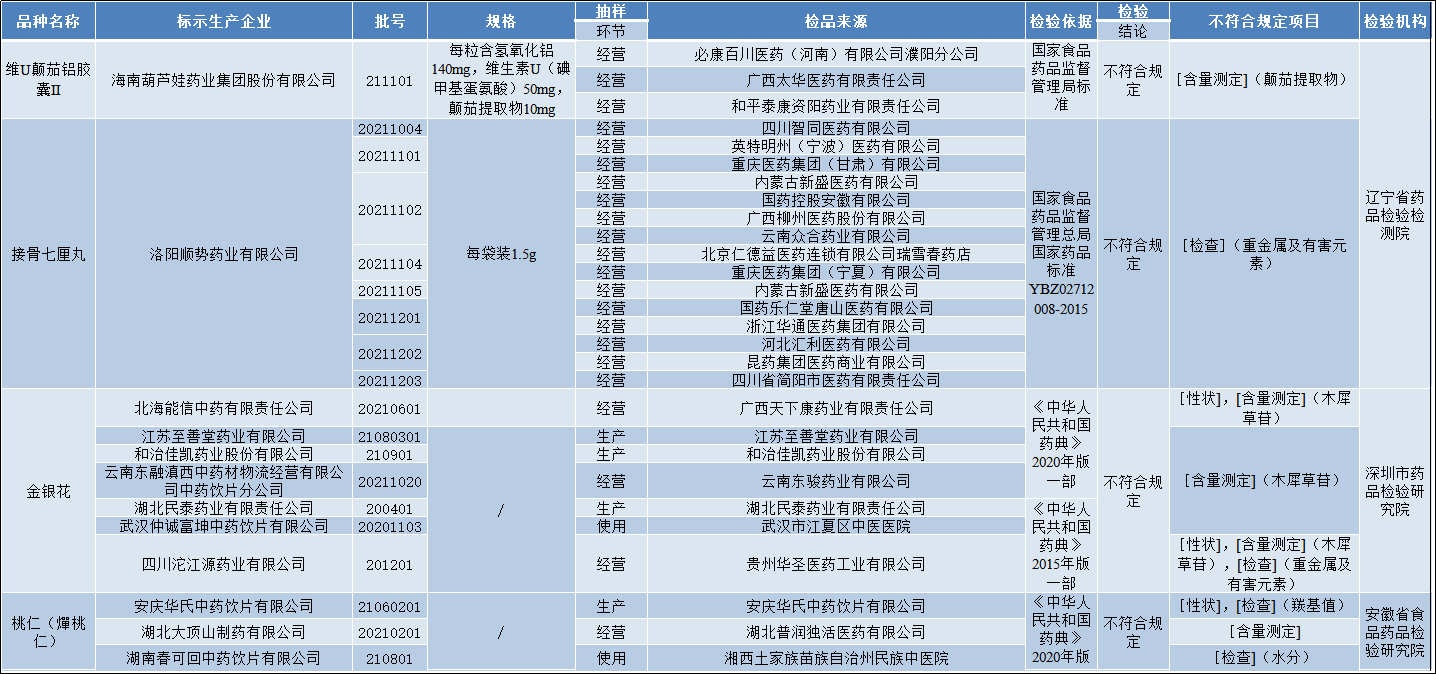
国家药监局关于19批次药品不符合规定的通告(2022年第55号)
经辽宁省药品检验检测院等3家药品检验机构检验,标示为洛阳顺势药业有限公司等12家企业生产的接骨七厘丸等19批次药品不符合规定。现将相关情况通告如下:
四、标准草案公示
2022-11-18日,药典委拟修订肾炎舒胶囊【WS3-136(Z-136)-2002Z】、康寿丸【WS3-B-2231-96】、通脉降脂片、通脉降脂胶囊【WS-10472(ZD-0472)-2002-2011Z】四个品种的国家药品标准,,为确保标准的科学性、合理性和适用性,现将拟修订国家药品标准公示征求社会各界意见。公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱。
五、产品上市
国家药品监督管理局批准氯巴占片上市
国家药品监督管理局通过优先审评审批程序批准宜昌人福药业有限责任公司申报的化学仿制药品氯巴占片上市,批准适应症为用于2岁及以上Lennox-Gastaut综合征(LGS)患者癫痫发作的联合治疗。LGS综合征是一种多发于儿童的以多类型的难治性癫痫发作、慢性脑病和智力缺陷为主要表现的严重慢性癫痫性脑病,预后差,严重影响患者生存质量及其家人的生活质量。该疾病在我国发病率和患病率极低,国内尚缺乏有效治疗药物。宜昌人福药业有限责任公司研发的氯巴占片作为国内首家氯巴占片仿制药上市,将为LGS综合征患者提供更多治疗选择,保障患者用药可及性。
六、其它通告
关于发布《国家药品监督管理局药品审评中心 海南省药品监督管理局 海南博鳌乐城国际医疗旅游先行区管理局开展药品真实世界研究工作实施办法》的通告
国家药品监督管理局药品审评中心与海南省药品监督管理局、海南博鳌乐城国际医疗旅游先行区管理局共同建立药品真实世界数据研究协调工作机制以来,应用试点工作的管理进入常态化、动态管理阶段,工作机制运转良好。为进一步巩固总结应用试点工作经验,优化完善工作机制,强化沟通交流程序,国家药监局药审中心会同海南省药监局、乐城管理局联合修订了《国家药品监督管理局药品审评中心 海南省药品监督管理局 海南博鳌乐城国际医疗旅游先行区管理局开展药品真实世界研究工作实施办法》。经国家药品监督管理局审核同意,现予发布,自发布之日起施行。
器械板块
一、产品上市与注销
1、人工血管获批上市
近日,国家药品监督管理局经审查,批准了江苏百优达生命科技有限公司生产的创新产品“人工血管”注册。人工血管主要由PET线编织制成,涂覆有牛胶原蛋白和甘油。该产品的聚酯编织采用创新编制工艺,外层经纱采用弹性纱线(涤纶低弹丝DTY纱线),中间层采用非弹性纱线(涤纶全牵伸FDY纱线),纬纱采用弹性纱线、非弹性纱线组成的复合纱线。该编制工艺使织物具有更小且更均匀的孔隙,预期将改进成品的渗血性能。人工血管用于主动脉及其分支血管的置换或旁路手术。该产品的上市将为临床治疗提供更多选择。
2、国家药监局关于注销医疗器械注册证书的公告
按照《医疗器械监督管理条例》的规定,根据企业申请,现注销安徽养和医疗器械设备有限公司半导体激光治疗系统的医疗器械注册证,注册证编号:国械注准20163091004。
二、说明书公示
1、关于高通量测序用外周血胎儿染色体拷贝数变异国家参考品说明书公示的通知
我院已完成高通量测序用外周血胎儿染色体拷贝数变异国家参考品的研制,现就说明书内容向社会公示并征求意见。请于2022年11月23日前将意见反馈至中检院体外诊断试剂检定所。
2、关于单纯疱疹病毒1+2型核酸检测试剂国家参考品说明书公示的通知
我单位已完成单纯疱疹病毒1+2型检测试剂国家参考品的研制,现就说明书内容向社会公示并征求意见。请于2022年11月28日前将意见反馈至中检院诊断试剂所。

