一、药品板块
1、关于公开征求《儿童抗肿瘤药物临床研发技术指导原则》意见的通知
https://www.bopuyun.com/pc/policy/item/28821
与成人抗肿瘤药物的研发热度相比,儿童抗肿瘤药的研发明显不足。儿童肿瘤治疗领域存在更为迫切的临床需求;同时,相较于成人,儿童抗肿瘤药物研发的难度也更大。为了对儿童抗肿瘤新药的临床研发提供思路和技术建议,药品审评中心组织撰写了《儿童抗肿瘤药物临床研发技术指导原则》,形成征求意见稿,供药物研发的申请人和研究者参考。我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。
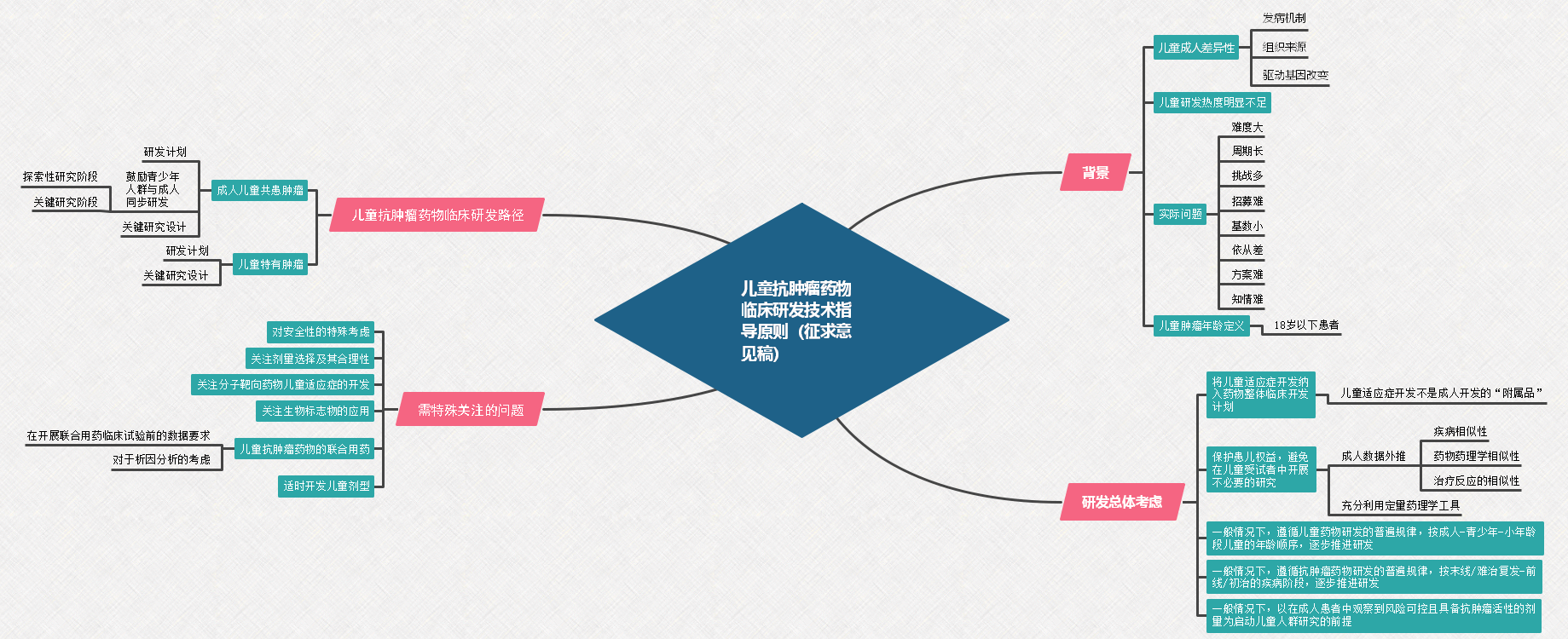
图 1 成人儿童共患肿瘤的抗肿瘤药物研发路径
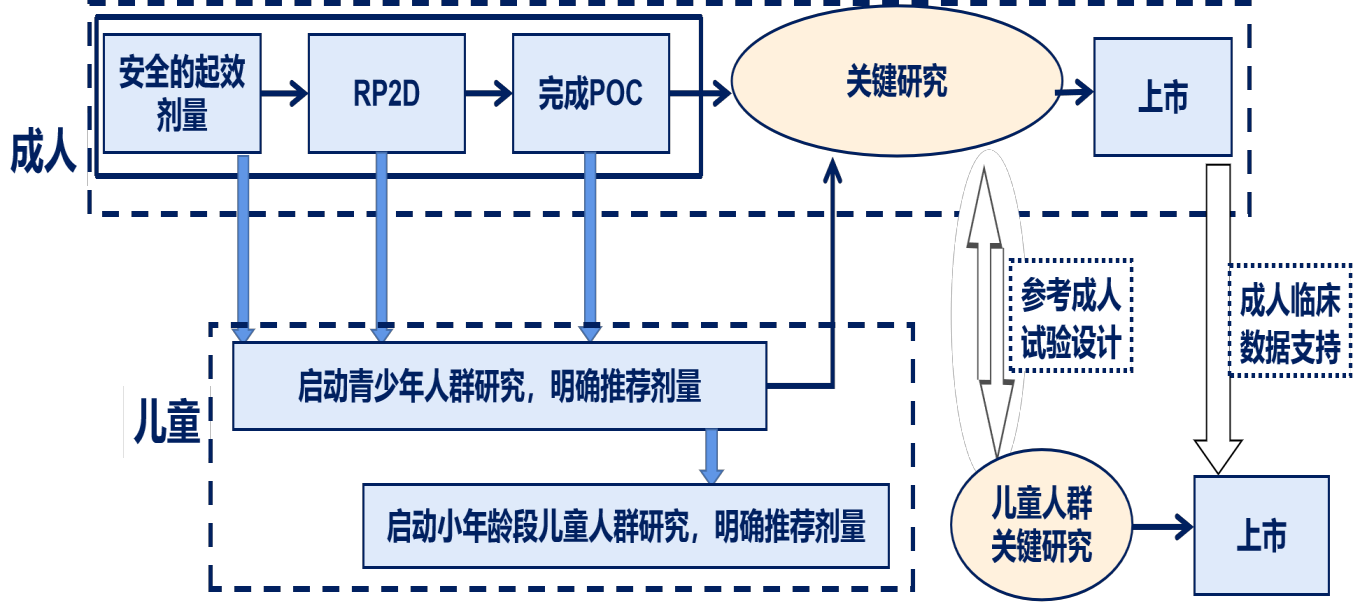
图 2 儿童特有肿瘤的抗肿瘤药物研发路径
2、国家药监局药审中心关于发布《化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则》的通告
国家药监局药审中心关于发布《化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则》
为了规范和指导化学仿制药口服调释制剂的药学研发,在国家药品监督管理局的部署下,药审中心组织制定了《化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则》。自发布之日起施行。
口服调释制剂(Oral modified-release formulations):系指与普通口服制剂相比,通过技术手段调节药物的释放速率、释放部位或释放时间的一大类制剂。
乙醇剂量倾泻(Alcohol-induced dose-dumpling, ADD):是指含酒精饮料与药物同服引发的调释制剂剂量突释现象。
适用范围:适用于化学仿制药口服固体调释制剂。
目的:阐述乙醇剂量倾泻试验的具体试验方法设计,为化学仿制药口服调释制剂的药学研发和使用提供技术指导参考。
总体思路:研究者结合选定的参比制剂和具体品种情况等进行。该项研究应在处方设计时就予以考虑。
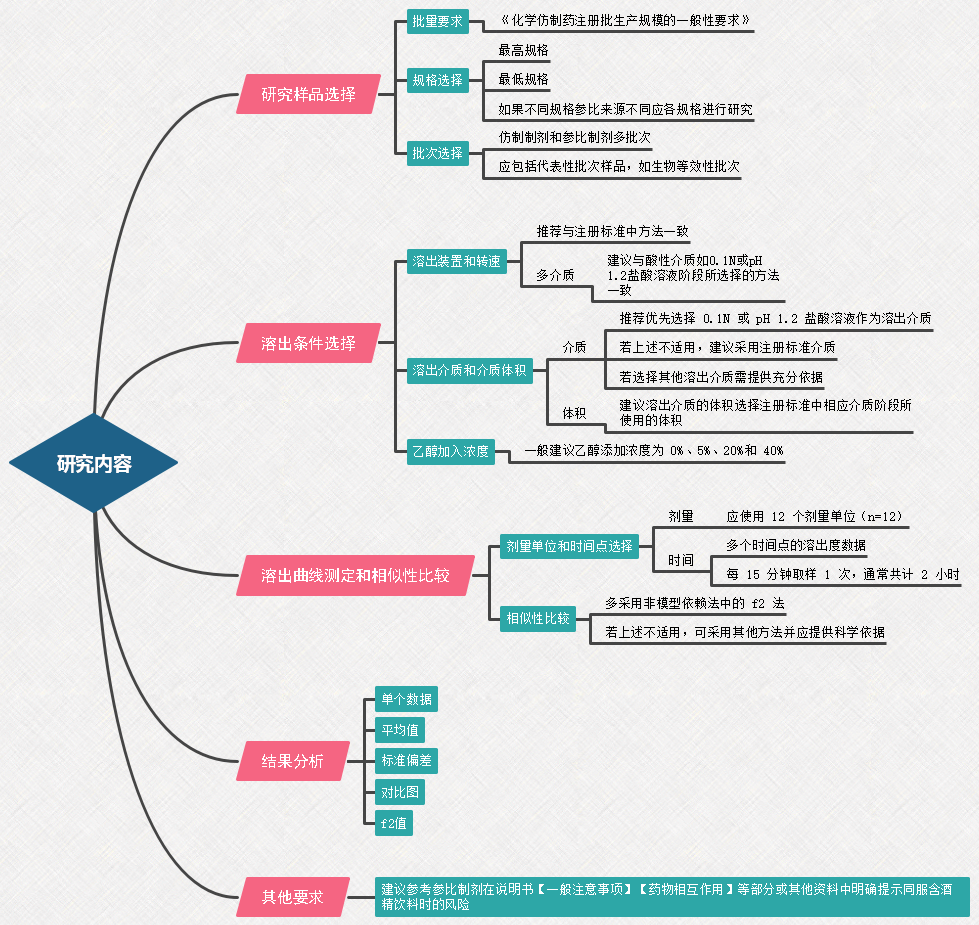
研究内容:
3、国家药监局药审中心关于发布《〈已上市化学药品药学变更研究技术指导原则(试行)〉溶出曲线研究的问答》的通告
国家药监局药审中心关于发布《〈已上市化学药品药学变更研究技术指导原则(试行)〉溶出曲线研究的问答》的通告
为规范和指导已上市化学药品药学变更时的溶出曲线研究,提供可参考的技术标准,在国家药品监督管理局的部署下,药审中心组织制定了《〈已上市化学药品药学变更研究技术指导原则(试行)〉溶出曲线研究的问答》。自发布之日起施行。
问答1.研究样品如何选择?
问答2.溶出介质如何选择?
问答3.装置及转速如何选择?
问答4.溶出介质的体积、温度、样品数量等如何选择?
问答5.溶出曲线具有规格依赖性的药物如何进行不同规格的溶出曲线对比研究?
问答6.溶出曲线取样点如何选择以及溶出曲线相似性如何评价?
问答7:缓控释制剂及肠溶制剂的溶出曲线研究
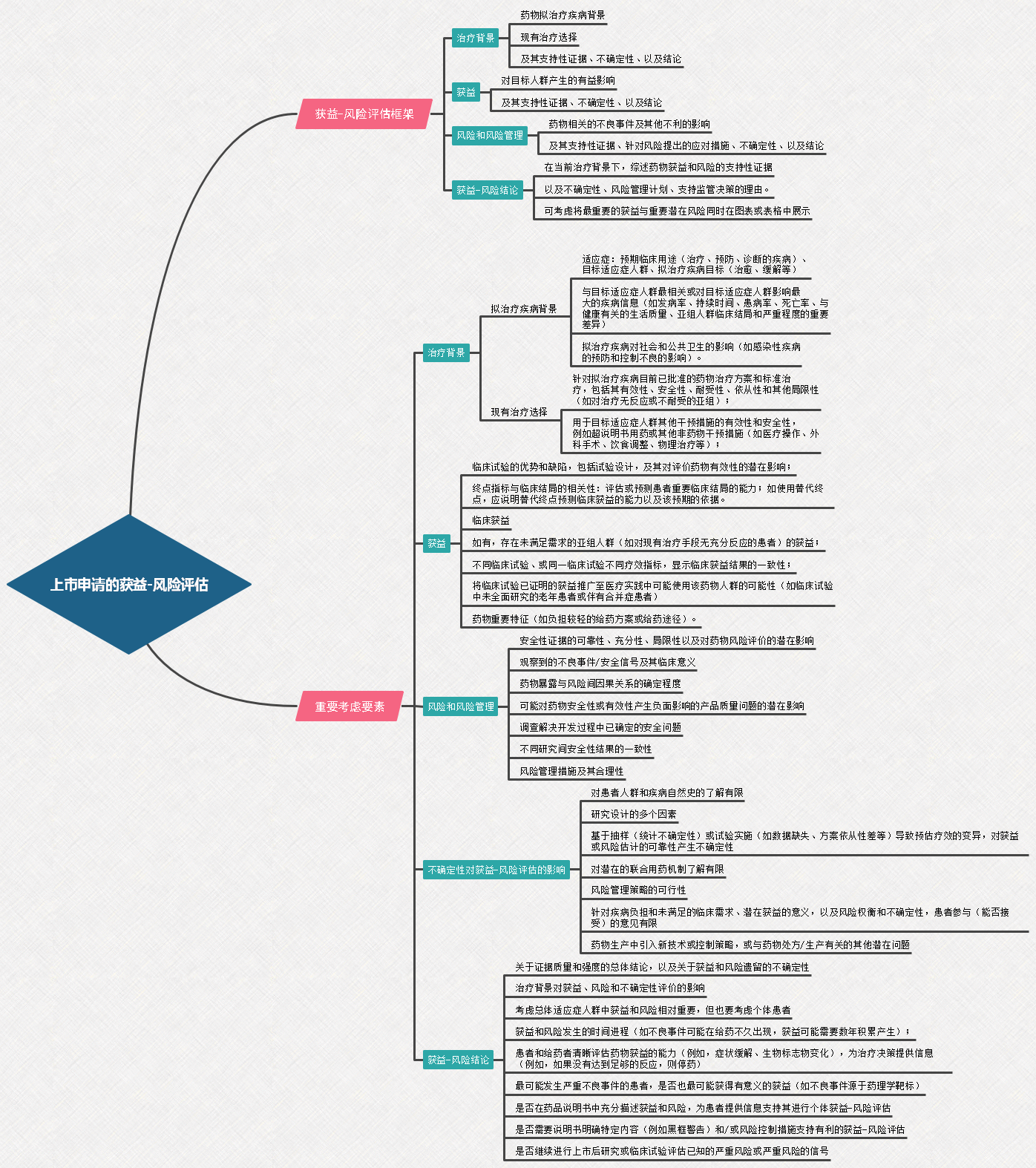
4、关于公开征求《新药获益-风险评估技术指导原则》意见的通知
关于公开征求《新药获益-风险评估技术指导原则》意见的通知
为进一步规范和指导药物临床研发和评价中的获益-风险评估,提供可参考的技术规范,药审中心起草了《新药获益-风险评估技术指导原则》。征求意见时限为自发布之日起1个月。
本指导原则阐明了获益-风险评估监管背景和总体考虑,如何在上市申请中呈现药物的获益和风险信息,上市申请中获益-风险评估的框架、重要考虑要素,以及申请人如何通过药物研发的设计和实施,为获益-风险评估提供信息等。本指导原则适用于化学药品和治疗用生物制品临床研发和上市申请的获益-风险评估。
5、国家药监局召开中药管理战略决策专家咨询委员会会议
11月3日,国家药监局在京召开中药管理战略决策专家咨询委员会(以下简称决咨委)会议,贯彻落实党的二十大精神,针对促进中药传承创新发展、加强中药全链条监管及近期重点工作,广泛深入听取委员们意见建议,为中药科学监管汇智聚力。会议由决咨委主任委员孙咸泽主持,国家药监局副局长赵军宁出席会议并讲话。
会议立足于促进中药传承创新发展,围绕《中药注册管理专门规定(征求意见稿)》及强化中药监管具体措施等,邀请委员们把脉问诊。与会委员按照会议主题,结合所在专业领域,从不同角度进行深入细致讨论。会议还对《中药管理战略决策专家咨询委员会章程(草案)》进行研究讨论。
至于《中药注册管理专门规定(征求意见稿)》何时试行只能拭目以待了。
6、国家药监局附条件批准林普利塞片上市
近日,国家药品监督管理局通过优先审评审批程序附条件批准上海璎黎药业有限公司申报的1类创新药林普利塞片(商品名:因他瑞)上市。该药为我国自主研发并拥有自主知识产权的创新药,适用于既往接受过至少两种系统性治疗的复发或难治滤泡性淋巴瘤成人患者。林普利塞为磷脂酰肌醇-3-激酶的δ亚型(PI3Kδ)选择性抑制剂。林普利塞片可抑制PI3Kδ蛋白的表达,降低AKT蛋白磷酸化水平,从而诱导细胞凋亡以及抑制恶性B细胞和原发肿瘤细胞的增殖。该药品的上市为经现有治疗手段治疗后复发难治的滤泡淋巴瘤成人患者提供了治疗选择。
7、关于举办《ICH S系列指导原则线上培训》的通知
为进一步提升国内监管机构和业界对ICH安全性指导原则的理解与掌握,加大宣传培训力度,国家药品监督管理局ICH工作办公室将于2022年11月17日开展《ICH S系列指导原则线上培训》,主要围绕3个S系列指导原则进行解读。现将培训有关事项通知如下:
8、国家药监局药审中心关于发布《药品注册申请审评期间变更工作程序(试行)》的通知
国家药监局药审中心关于发布《药品注册申请审评期间变更工作程序(试行)》的通知
为配合《药品注册管理办法》的贯彻实施,进一步规范药品注册申请审评期间的变更,保证药品安全、有效和质量可控,药审中心组织制定了《药品注册申请审评期间变更工作程序(试行)》,现予以发布,自发布之日起实施。
撤回申请:药品上市许可申请审评期间,发生可能影响药品安全性、有效性和质量可控性的重大变更的,申请人应当撤回原注册申请,补充研究后重新申报。药物临床试验申请、药品上市许可申请、补充申请和境外生产药品再注册申请等技术审评期间发生的其他变更适用于本程序。
为保证审评质量与效率,审评期间,申请人或药品上市许可持有人提出的变更,不应影响原申报事项的技术审评。
药品上市注册申请审评期间确需发生变更的,鼓励申请人提前与药审中心沟通交流
药物临床试验申请和临床试验期间的补充申请审评期间的变更
药品上市许可申请审评期间的变更
上市后补充申请、境外生产药品再注册申请审评期间的变更
其他
9、国家药监局关于修订间苯三酚注射剂说明书的公告(2022年第102号)
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对间苯三酚注射剂(包括间苯三酚注射液、注射用间苯三酚)说明书内容进行统一修订。现将有关事项公告如下:
二、器械板块
1、关于环孢霉素A、他克莫司、西罗莫司、依维莫司复合冰冻人全血国家标准品
中检院已完成环孢霉素A、他克莫司、西罗莫司、依维莫司复合冰冻人全血国家标准品的研制,现就说明书内容向社会公示并征求意见。请于2022年11月17日前将意见通过邮件方式反馈至中国食品药品检定研究院体外诊断试剂检定所。
2、左心耳封堵器系统获批上市
近日,国家药品监督管理局经审查,批准了杭州德诺电生理医疗科技有限公司生产的创新产品“左心耳封堵器系统”注册。
左心耳封堵器系统由左心耳封堵器和输送器组成,其中左心耳封堵器由密封盘和锚定盘连接而成。输送器由输送鞘管、扩张器、装载器、输送钢缆和止血阀组成。该产品的密封盘和锚定盘的设计均采用了创新的专利设计,充分利用了镍钛丝编织结构的自适应性,一定程度上可满足临床对不同形态左心耳的封堵需求。
该产品适用于有卒中风险(CHA2DS2-VASc评分≥2分)且长期口服抗凝治疗禁忌的非瓣膜性房颤患者。产品的上市预期让更多的患者受益。
3、关于对口腔数字化医疗器械标准化技术归口单位组建信息公示的通知
根据《国家药监局综合司关于同意筹建口腔数字化医疗器械标准化技术归口单位的复函》(药监综械注函〔2022〕295号)的相关要求,现对组建的口腔数字化医疗器械标准化技术归口单位组建信息面向社会进行公示,公示期30天。有关单位或个人如有意见建议,请于2022年12月8日前将意见发送至邮箱yys-xbs@nifdc.org.cn。邮件主题请注明口腔数字化医疗器械标准化技术归口单位反馈意见以及单位或个人名称。

