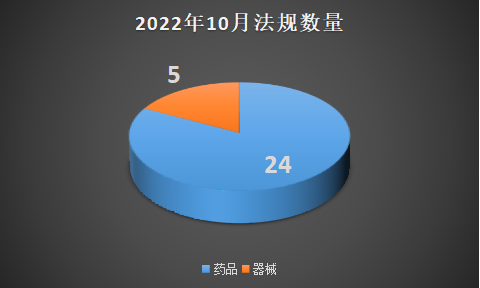
2022年10月法规数量
一、药品板块
本月药品板块内容包含新文件实施、指导原则征求意见、参比制剂、通知公告、产品上市五大内容。
1、新文件实施
2022-10-09 国家药监局药审中心关于发布《阿司匹林肠溶片生物等效性研究技术指导原则》的通告
为不断丰富完善仿制药个药指导原则并持续推进一致性评价工作,进一步指导阿司匹林肠溶片生物等效性研究的实施和评价,药审中心组织起草了《阿司匹林肠溶片生物等效性研究技术指导原则》现予发布,自发布之日起施行。
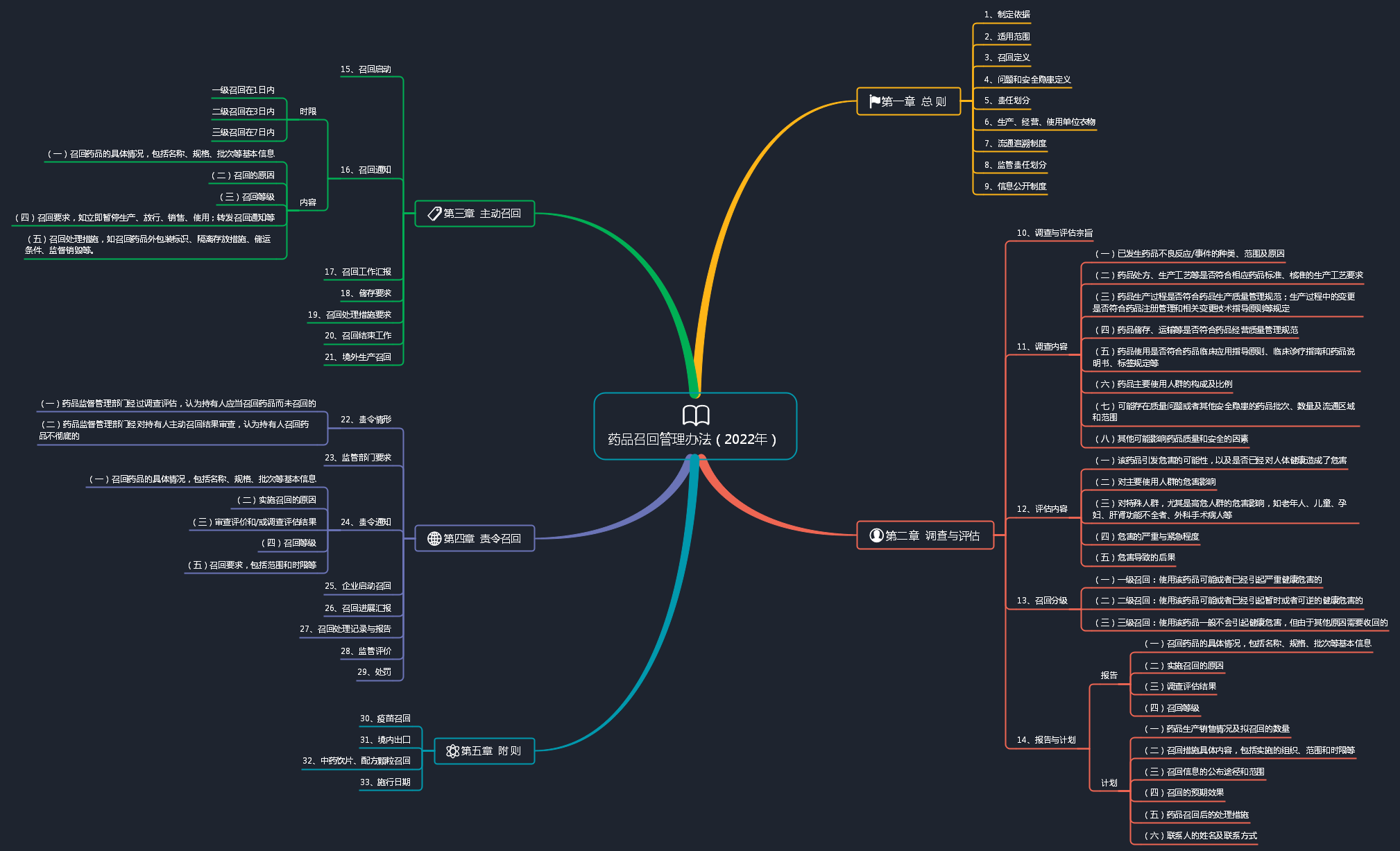
2022-10-26 药品召回管理办法(2022年)
2022年10月26日,国家药品监督管理局发布了《药品召回管理办法》(2022年),该办法共计包括31条,设计内容主要包括总则、调查与评估、主动召回、责令召回和附则5个章节,详细内容见导图。
2022-10-26 《药品召回管理办法》政策解读
2022年10月26日,国家局发布了《药品召回管理办法》(2022年)解读文件,该解读文件包含以下7项主要内容:
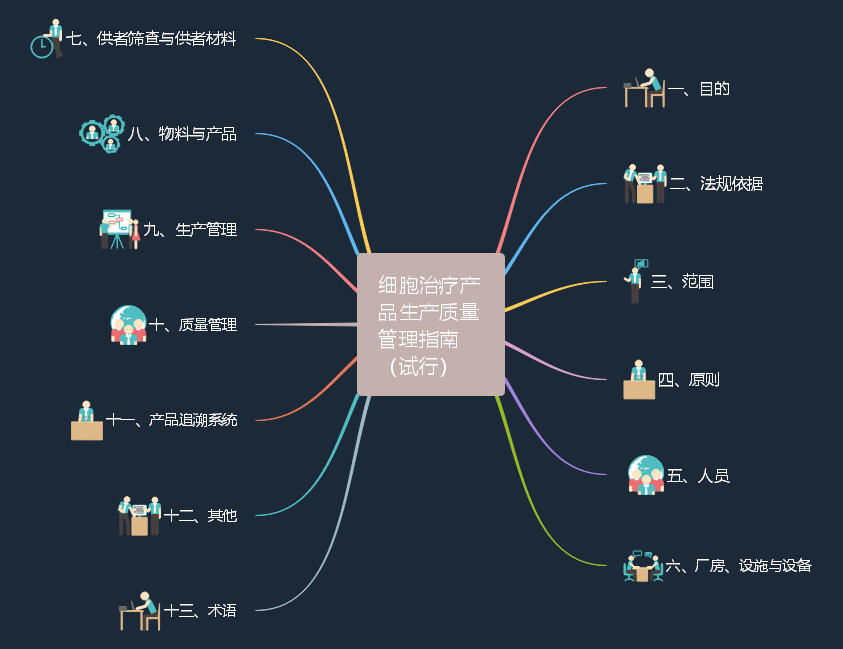
2022-10-31 国家药品监督管理局食品药品审核查验中心关于发布《细胞治疗产品生产质量管理指南(试行)》的通告(2022年 第4号)
为指导药品上市许可持有人规范开展细胞治疗产品的生产和质量管理,保证产品质量,核查中心组织研究起草了《细胞治疗产品生产质量管理指南(试行)》,现予发布,请参照执行。详细内容,参看链接。
2、指导原则征求意见
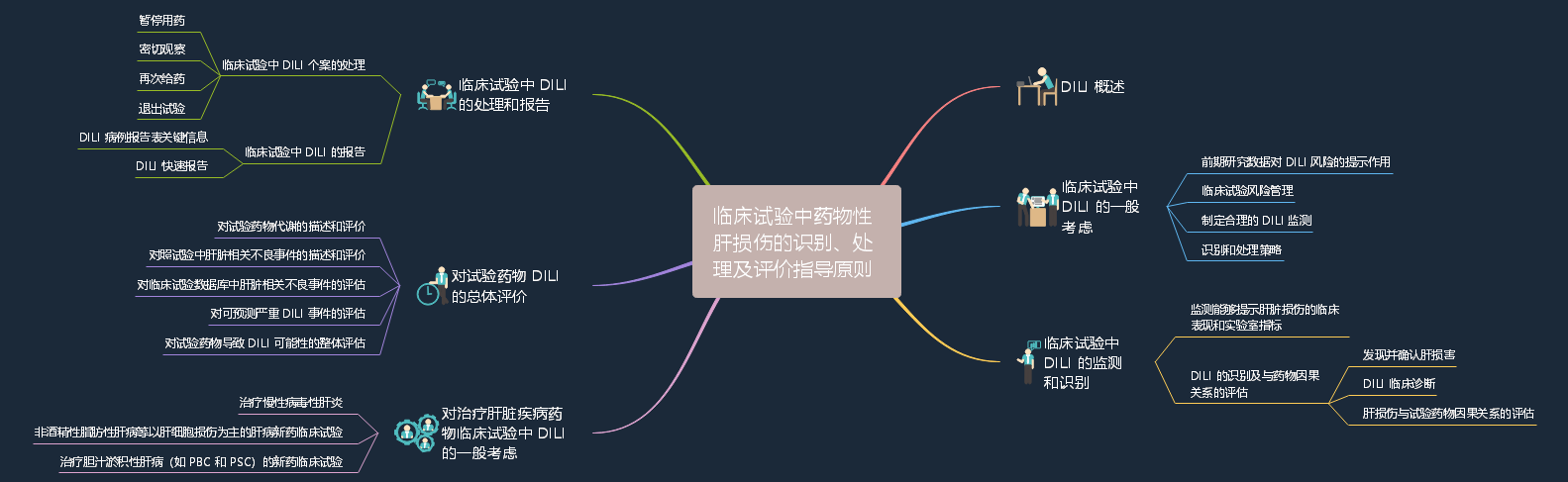
2022-10-08 关于公开征求《临床试验中药物性肝损伤的识别、处理及评价指导原则》意见的通知
为进一步指导评估药物临床试验中药物性肝损伤的潜在可能性,保障受试者安全,同时获得安全性信息以评估试验药物的风险特征。药审中心起草了《临床试验中药物性肝损伤的识别、处理及评价指导原则》,经中心内部讨论,已形成征求意见稿。征求意见时限为自发布之日起1个月。
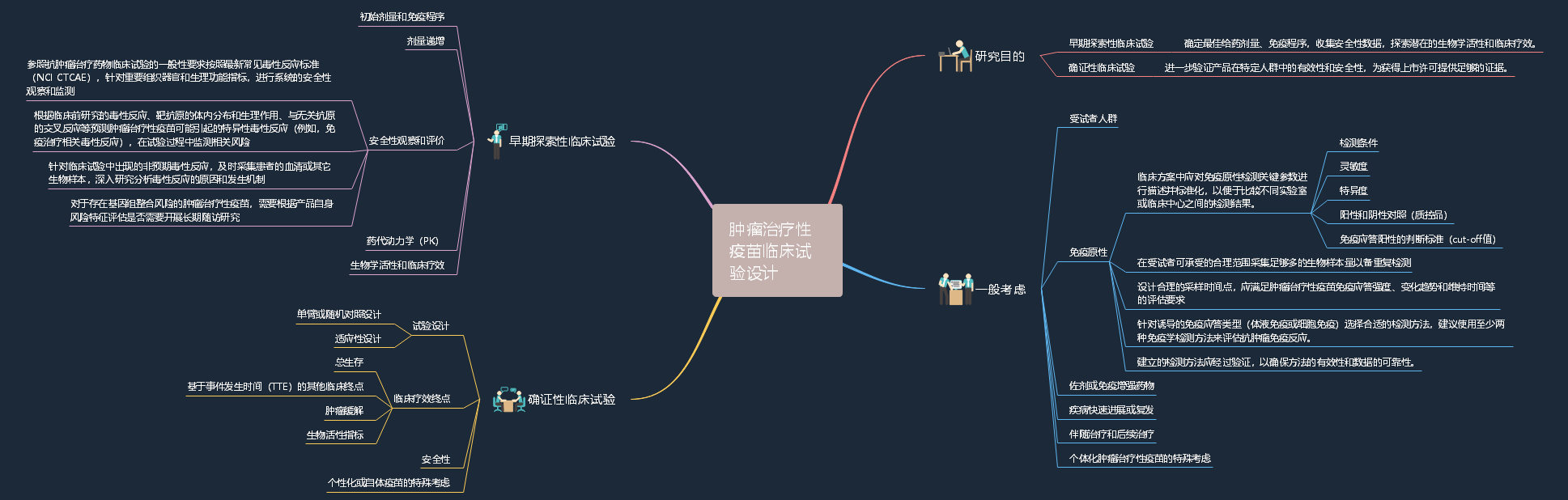
2022-10-09 关于公开征求《肿瘤治疗性疫苗临床试验技术指导原则(征求意见稿)》意见的通知
肿瘤治疗性疫苗作用机制是通过抗原呈递细胞(APC)将抗原加工并呈递给T细胞,从而诱导产生或放大已存在的抗原特异性T细胞反应,这一系列的免疫反应过程需要较长时间。与传统细胞毒药物、靶向治疗或其它肿瘤免疫治疗药物相比,肿瘤治疗性疫苗的临床试验设计存在诸多不同考虑。考虑到国内尚无相关指导原则对这类产品的临床设计进行规范指导,药审中心在充分调研国内外同品种研发情况以及相关临床试验技术要求基础上,起草了《肿瘤治疗性疫苗临床试验技术指导原则(征求意见稿)》。征求意见时限为自发布之日起1个月。
2022-10-09 关于公开征求《基因治疗血友病临床试验设计技术指导原则(征求意见稿)》意见的通知
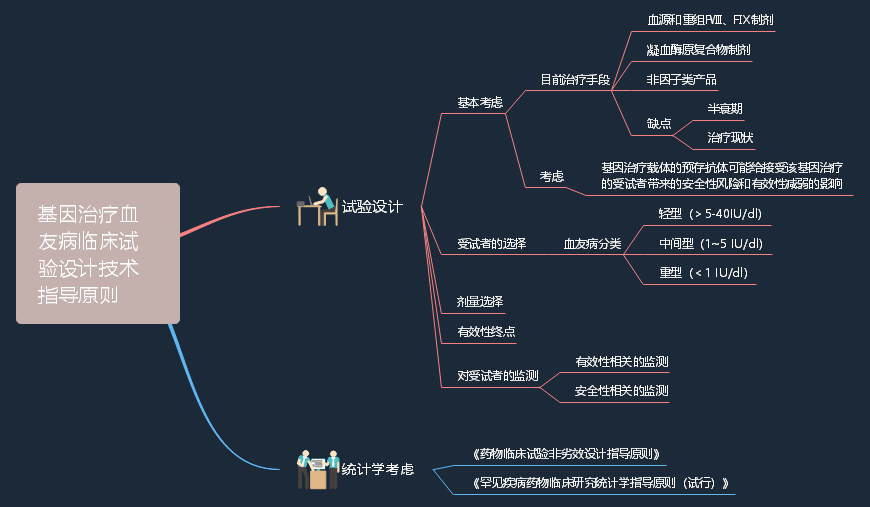
近年来,基因治疗已成为研发热点之一,该类产品具有创新性和复杂性,有必要对临床试验设计提出要求和提供指导。药审中心在充分调研的基础上起草了《基因治疗血友病临床试验设计技术指导原则(征求意见稿)》。征求意见时限为自发布之日起1个月。
2022-10-10 关于公开征求《非无菌化学药品及原辅料微生物限度研究技术指导原则(征求意见稿)》
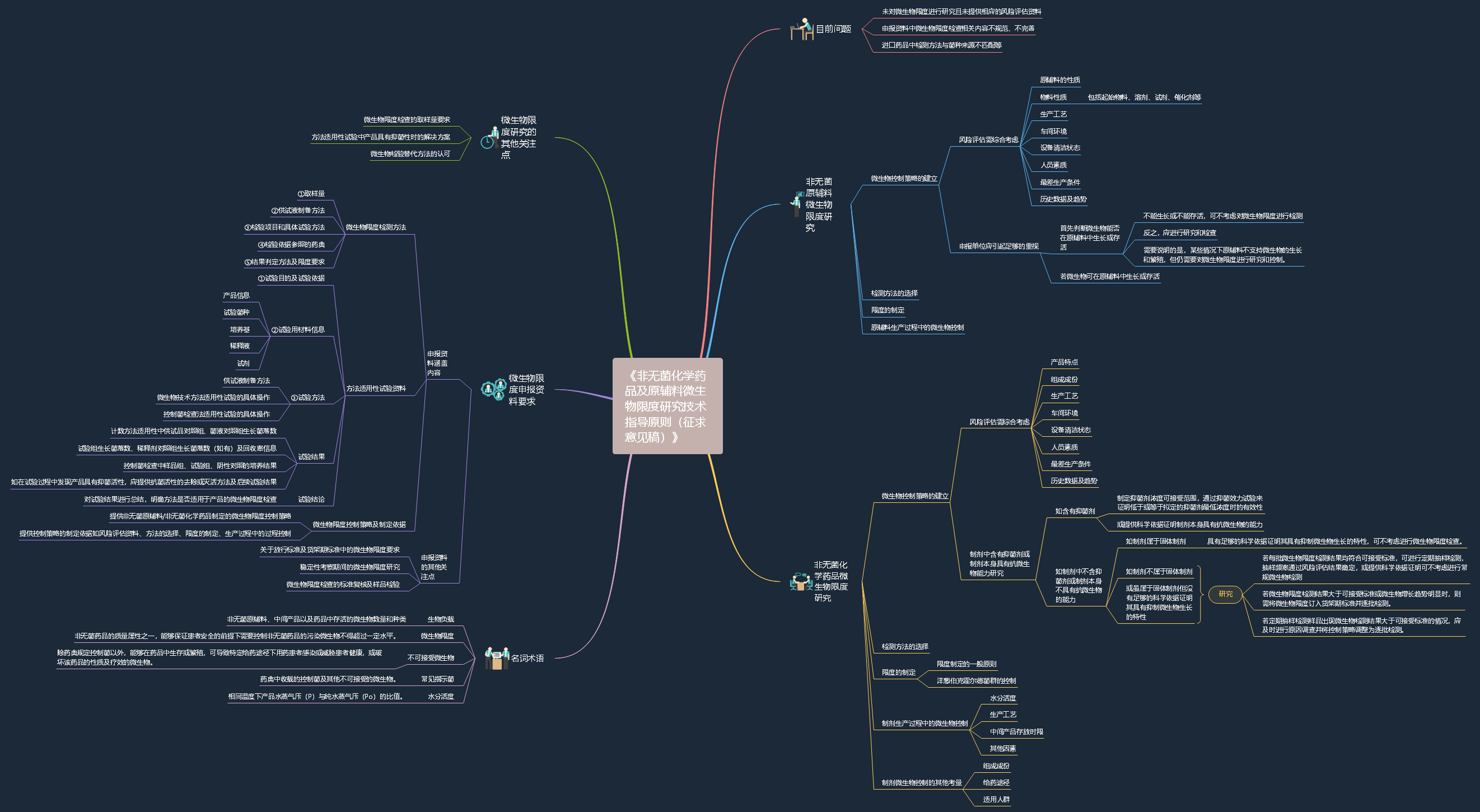
为进一步加强质量风险管理在产品质量控制中的应用,提高非无菌化学药品及原辅料微生物限度标准制定的科学性及合理性,明确申报资料中微生物限度研究及控制的相关要求,药审中心经调研以及与专家和业界讨论,组织起草了《非无菌化学药品及原辅料微生物限度研究技术指导原则(征求意见稿)》。征求意见时限为自发布之日起1个月。
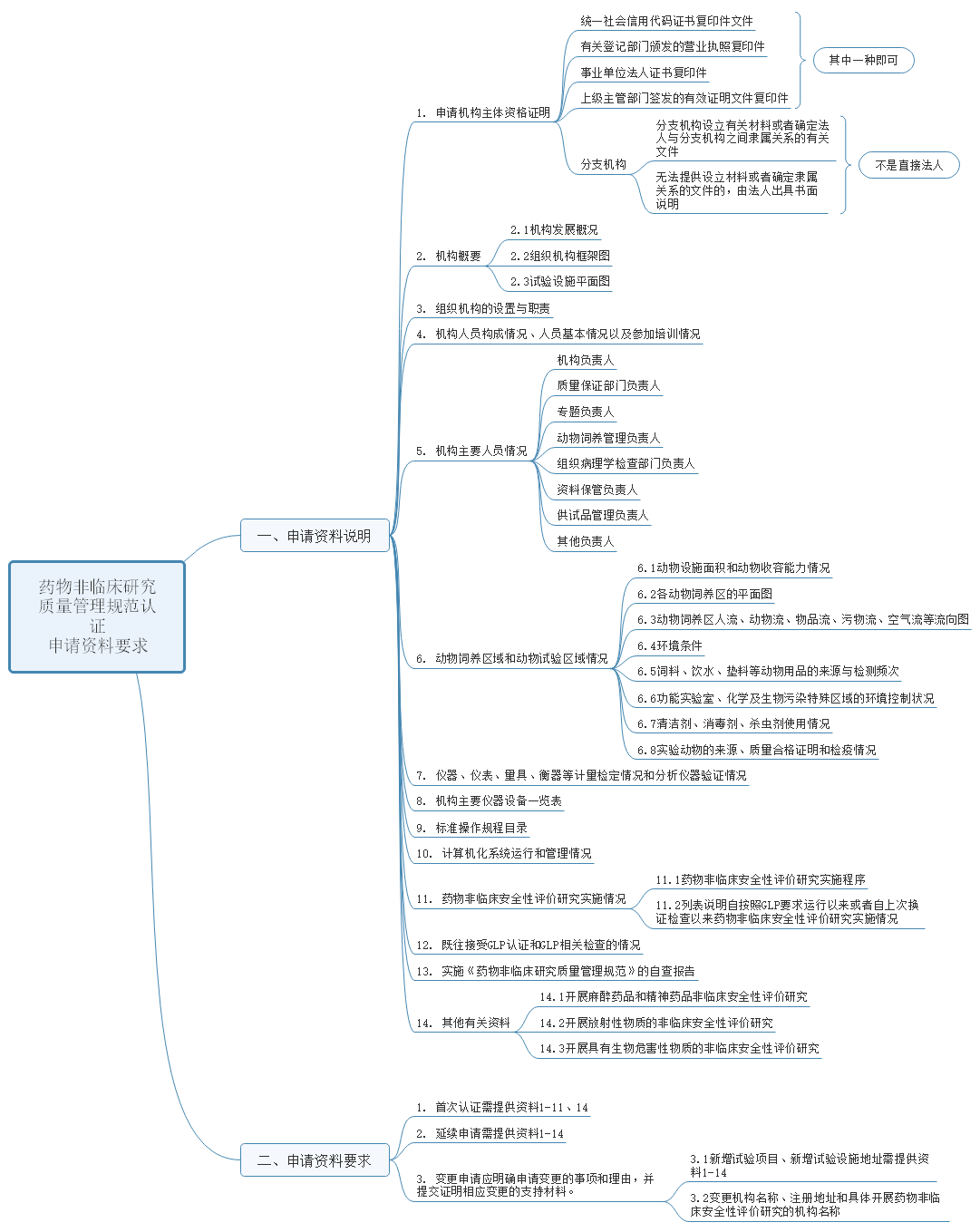
2022-10-21 国家药监局综合司公开征求《药物非临床研究质量管理规范认证管理办法(征求意见稿)》意见
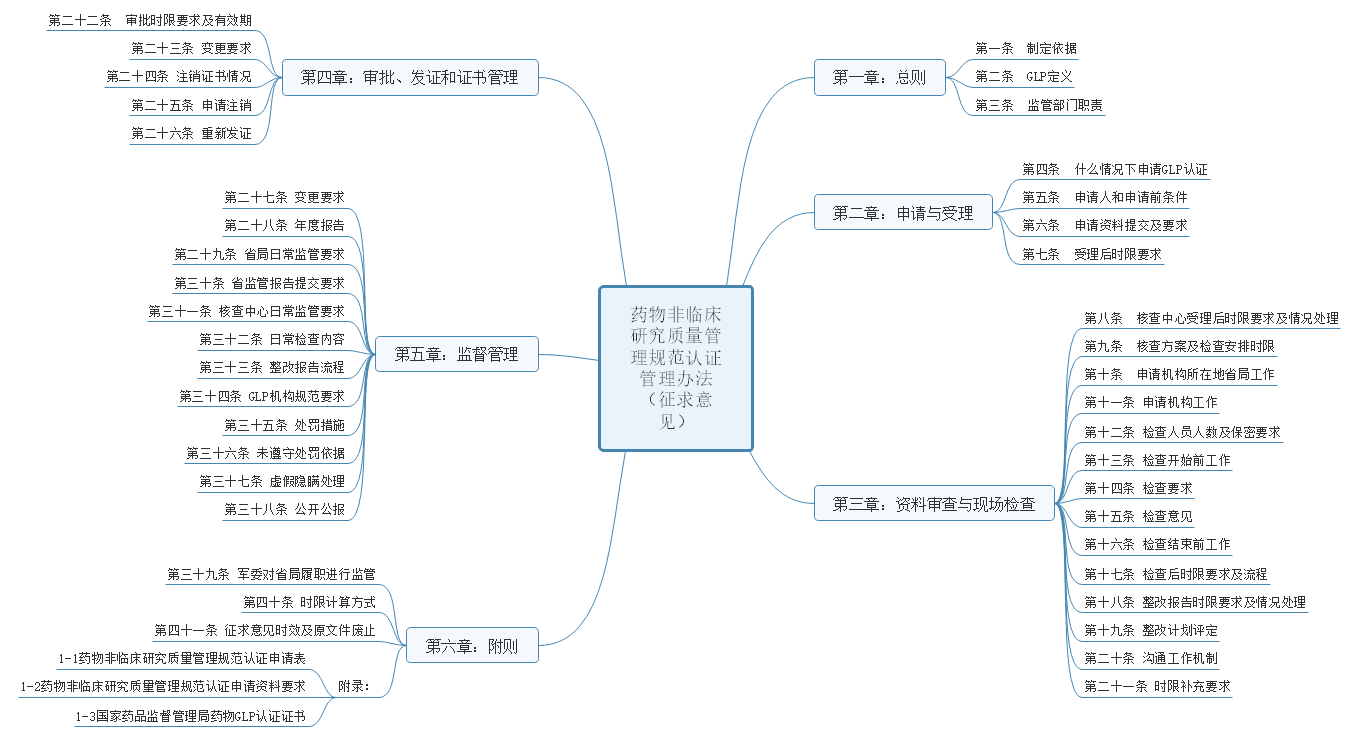
该办法共包括6章内容:总则、申请与受理、资料审查与现场检查、审批发证和证书管理、监督管理、附则。具体内容见下图。
另外该办法同时也对申办资料做了具体要求,资料共分申请资料说明和要求两大部分内容,其中资料说明包括资质证明、机构概要、职责、人员情况、试验区域情况、仪器等校验情况、仪器设备一览表、文件目录、计算机运行情况、实施情况、以往检查情况、自检报告、其他资料,共计14项内容。详细内容见下图。
2022-10-25 关于公开征求《慢性乙型肝炎治疗药物临床试验技术指导原则》意见的通知
为进一步规范和指导慢性乙型肝炎治疗药物临床试验,提供可参考的技术规范,药审中心起草了《慢性乙型肝炎治疗药物临床试验技术指导原则》,经中心内部讨论,已形成征求意见稿。征求意见时限为自发布之日起1个月。
2022-10-25 关于公开征求《新药临床安全性评价技术指导原则》意见的通知
新药临床安全性评价是新药获益-风险评估的重要基础。为进一步科学指导新药安全性评价,药审中心起草了《新药临床安全性评价技术指导原则》,经中心内部讨论,已形成征求意见稿。征求意见时限为自发布之日起1个月。
2022-10-25 关于公开征求《化学合成多肽药物药学研究技术指导原则(征求意见稿)》意见的通知
为明确化学合成多肽药物的药学研究技术要求,以更好的指导企业进行研究以及统一监管要求,药审中心经调研以及与专家和业界讨论,组织起草了《化学合成多肽药物药学研究技术指导原则(征求意见稿)》。 征求意见时限为自发布之日起1个月。
2022-10-26 关于公开征求《人乳头瘤病毒疫苗临床试验技术指导原则(征求意见稿)》意见的通知
近年来,人乳头瘤病毒(HPV)疫苗的研发如火如荼,多个HPV疫苗获批开展临床试验,型别从二价到十五价不等。HPV疫苗研发周期长,研发成本高昂,为指导疫苗企业规范研发,加快相关产品的上市,药审中心起草了《人乳头瘤病毒疫苗临床试验技术指导原则(征求意见稿)》。征求意见时限为自发布之日起1个月。
2022-10-27 关于公开征求《药物临床试验方案审评工作规范(征求意见稿)》意见的通知
临床试验方案是药审中心对临床试验申请开展审评和基于临床试验方案进行沟通交流的核心资料,临床试验方案设计关系到药物临床试验的质量,同时也是保障受试者安全和获得高品质数据的关键内容。为提高申请人撰写临床试验方案的质量、规范针对临床试验方案的沟通交流和各类注册申请,提高临床试验方案的审评质量,加强对申请人的技术指导,药审中心起草了《药物临床试验方案审评工作规范(征求意见稿)》。征求意见时限为自发布之日起1个月。
3、参比制剂
2022-10-09 关于公开征求《化学仿制药参比制剂目录(第六十三批)》(征求意见稿)意见的通知
药审中心组织遴选了第六十三批参比制剂,现予以公示征求意见。公示期限:2022年10月9日~2022年10月20日(10个工作日)
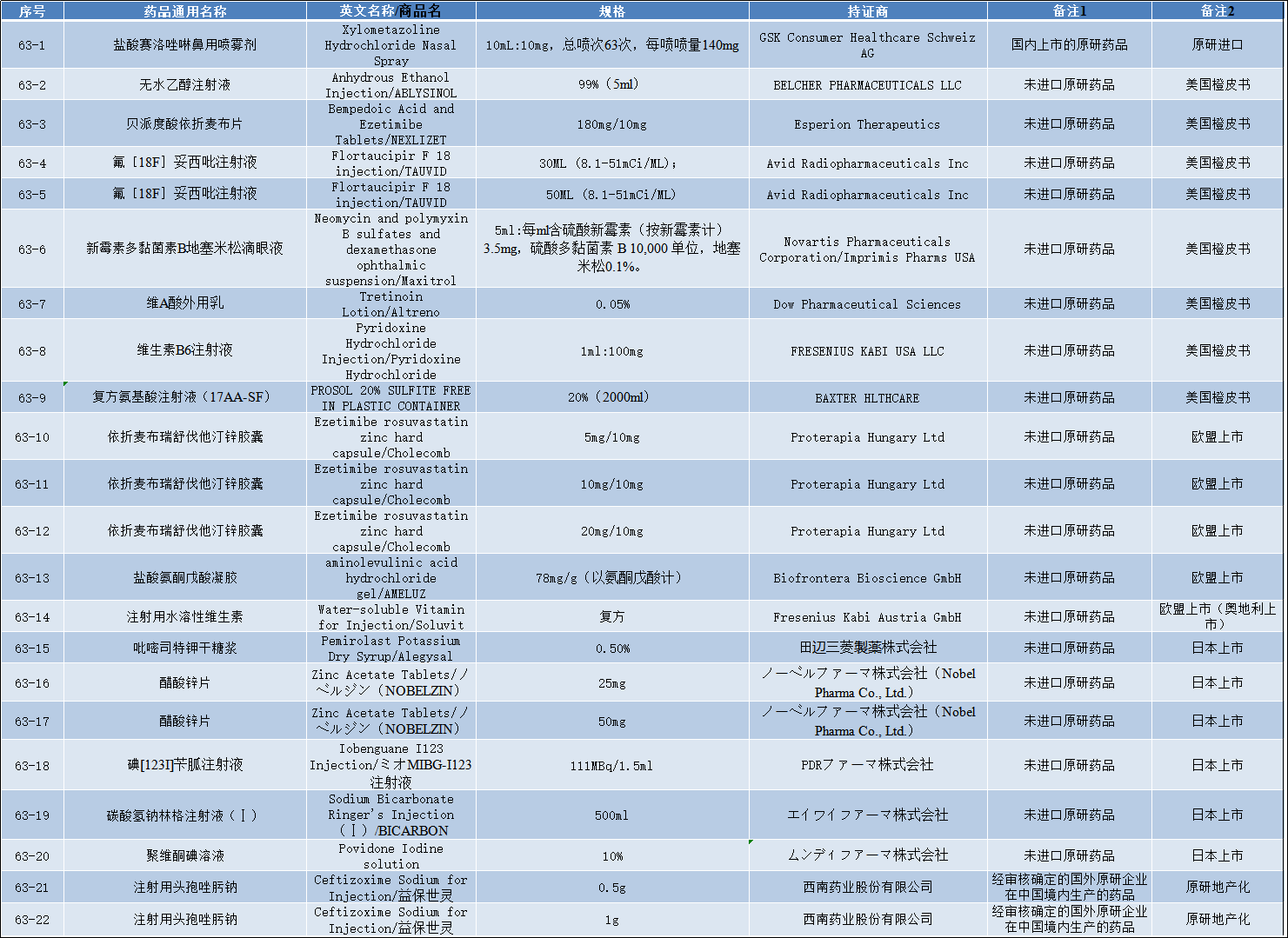
2022-10-28 关于公开征求《化学仿制药参比制剂目录(第六十四批)》(征求意见稿)意见的通知
药审中心组织遴选了第六十四批参比制剂,现予以公示征求意见。公示期限:2022年10月29日~2022年11月11日(10个工作日)。
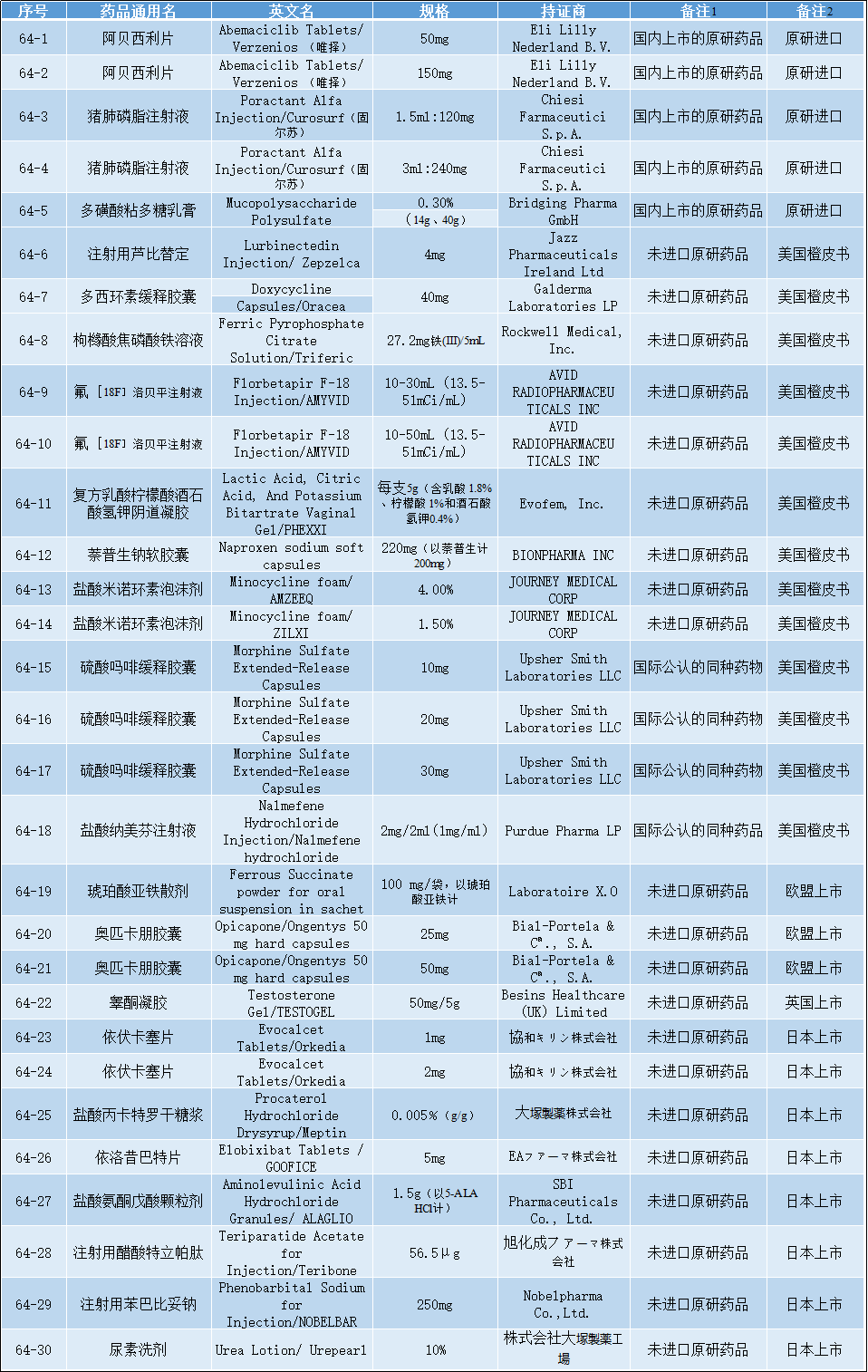
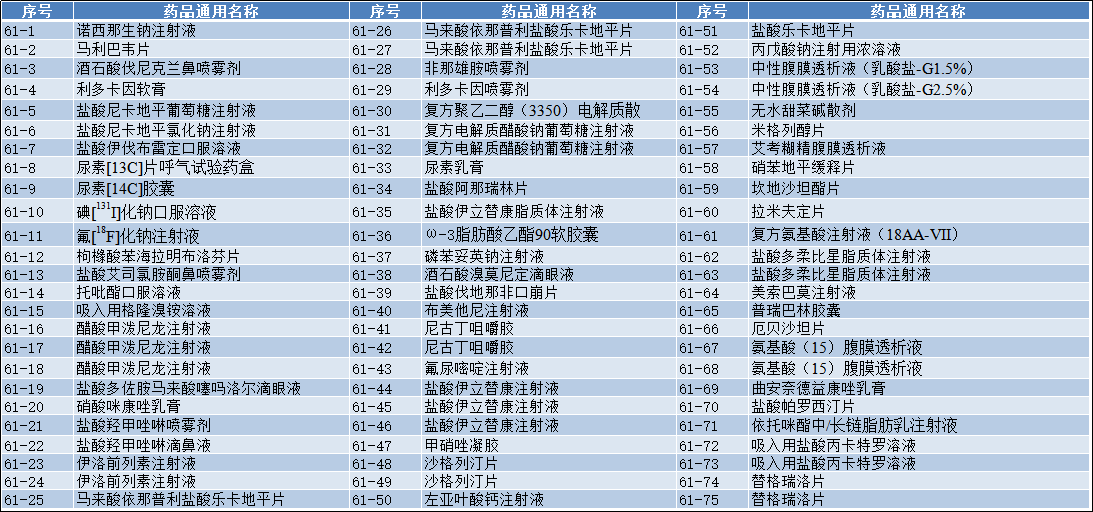
2022-10-20 国家药监局关于发布仿制药参比制剂目录(第六十一批)的通告
经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第六十一批)。
4、通知公告
2022-10-09 国家药监局关于发放药品电子注册证的公告意见的通知
自2022年11月1日起,国家药监局发放药品电子注册证。公告内容如下:
2022-10-12 国家药监局关于启用生物制品批签发电子证明、麻醉药品和精神药品实验研究立项电子批件的公告
自2022年11月1日起,对签发的生物制品批签发证明、麻醉药品和精神药品实验研究立项批件启用电子证照。实行电子证照后,推送成功即送达,原则上不再发放纸质证照。
2022-10-18 国家药监局关于修订己酮可可碱注射剂说明书的公告
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对己酮可可碱注射剂(包括己酮可可碱注射液、注射用己酮可可碱、己酮可可碱氯化钠注射液、己酮可可碱葡萄糖注射液)说明书内容进行统一修订。现将有关事项公告如下:
2022-10-21 《中国食品药品检定研究院2021年度科技报告》发布
在中检院科研管理处的组织下,经全院各部门和有关课题负责人共同努力,《中国食品药品检定研究院2021年度科技报告》编纂完成,现予以发布。报告比较全面总结和展示了中检院2021年度科技工作成效,供广大食品药品监督、检验人员和研究人员交流和参考。

2022-10-27 国家药监局关于修订多潘立酮制剂说明书的公告(2022年第93号)
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对多潘立酮制剂(包括多潘立酮片、多潘立酮分散片、多潘立酮口腔崩解片、多潘立酮胶囊、多潘立酮混悬液、马来酸多潘立酮片)说明书内容进行统一修订。现将有关事项公告如下:
2022-10-31 关于国家药监局批准药品电子注册证统一使用“国家药品监督管理局药品注册专用章”电子印章有关事宜的通知
根据国家药监局发布的《关于发放药品电子注册证的公告》(2022年第83号),自2022年11月1日起,国家药监局批准的药品电子注册证统一使用“国家药品监督管理局药品注册专用章”电子印章。其中,“药物非临床研究质量管理规范认证证书”“进口药材批件”“进口药材补充批件”以及港澳已上市传统外用中成药的境内注册事项的“药品注册证书”“药品补充申请批准通知书”“药品再注册批准通知书”所用印章由原印章调整为“国家药品监督管理局药品注册专用章”电子印章。各省级药品监督管理部门现使用的“国家药品监督管理局进口药品注册专用章”编号(1—31)自2022年11月1日起停止使用,并请于12月31日前缴回国家药监局药品注册司。
5、产品上市
2022-10-08 国家药监局批准多格列艾汀片上市
国家药品监督管理局发布批准华领医药技术(上海)有限公司申报的1类创新药多格列艾汀片(商品名:华堂宁)上市。该药品适用于改善成人2型糖尿病患者的血糖控制。多格列艾汀是葡萄糖激酶(GK)激活剂,作用于胰岛、肠道内分泌细胞以及肝脏等葡萄糖储存与输出器官中的葡萄糖激酶靶点,改善2型糖尿病患者血糖稳态失调。该药品的上市为2型糖尿病患者提供了新的治疗选择。
2022-10-09 国家药监局批准散寒化湿颗粒上市
国家药品监督管理局发布批准3.2类中药新药散寒化湿颗粒上市。该药品用于寒湿郁肺所致疫病。药品上市许可持有人为江苏康缘药业股份有限公司。该品种上市为疫病的治疗提供了又一种治疗选择。
二、器械板块
本月器械板块内容包括指导原则征求意见、产品注册与上市、通知公告三大内容。

1、指导原则征求意见
2022-10-17 关于征求《免疫组化类体外诊断试剂产品分类界定指导原则(征求意见稿)》意见的通知
按照国家药品监督管理局要求,国家药品监督管理局医疗器械标准管理中心牵头,组织医疗器械分类技术委员会临床检验专业组研究编制《免疫组化类体外诊断试剂产品分类界定指导原则》,形成征求意见稿及编制说明,现公开征求意见。2022年11月2日前发送至邮箱tws-xbs@nifdc.org.cn。
该指导原则对涉及免疫组化类体外诊断试剂产品分类的规则进行了梳理和细化。
管理类别界定:
2、产品注册与上市
2022-10-11 颅内动脉瘤手术计划软件获批上市
国家药品监督管理局经审查,发布批准了强联智创(北京)科技有限公司生产的“颅内动脉瘤手术计划软件”创新产品注册申请。该产品由应用程序和授权文件组成,软件功能模块包括数据加载、显示交互、数据管理、数据处理和日志。产品用于脑血管病患者X射线血管造影三维体层图像的显示、分割、测量和处理,辅助医生在神经介入手术时进行动脉瘤弹簧圈栓塞用的微导管路径和塑形规划。该产品利用医学图像处理技术对颅内动脉瘤患者的X射线血管造影三维体层图像进行处理,实现三维血管重建、动脉瘤分割和自动测量及微导管路径和塑形针形状规划,帮助医生进行术前方案规划。与传统神经介入手术方式相比,该产品可以提升微导管一次性到位率,缩短微导管输送时间,降低术中微导管反复推送对血管刺激导致的并发症发生概率,减少医生、患者X射线辐射时间。
2022-10-19 国家药监局关于注销医疗器械注册证书的公告
按照《医疗器械监督管理条例》的规定,根据企业申请,现注销和悦医疗股份公司(Heyer Medical AG)呼吸机(Ventilator)的医疗器械注册证,注册证号:国械注进20203083010。
2022-10-21 国家药监局关于批准注册222个医疗器械产品公告
国家局发布,2022年9月共批准注册医疗器械产品222个。其中,境内第三类医疗器械产品163个,进口第三类医疗器械产品24个,进口第二类医疗器械产品33个,港澳台医疗器械产品2个。(具体内容点击公告链接)
3、通知公告
2022-10-20 国家药监局关于发布YY 0719.2-2022《眼科光学 接触镜护理产品 第2部分:基本要求》等20项医疗器械行业标准及2项医疗器械行业标准修改单的公告
国家局发布YY 0719.2-2022《眼科光学 接触镜护理产品 第2部分:基本要求》等20项医疗器械行业标准及2项医疗器械行业标准修改单。

