概述:本周周报主要包括指导原则征求内容、指导原则发布内容、仿制药参比制剂、电子证书应用和产品上市情况。
一、指导原则征求通知
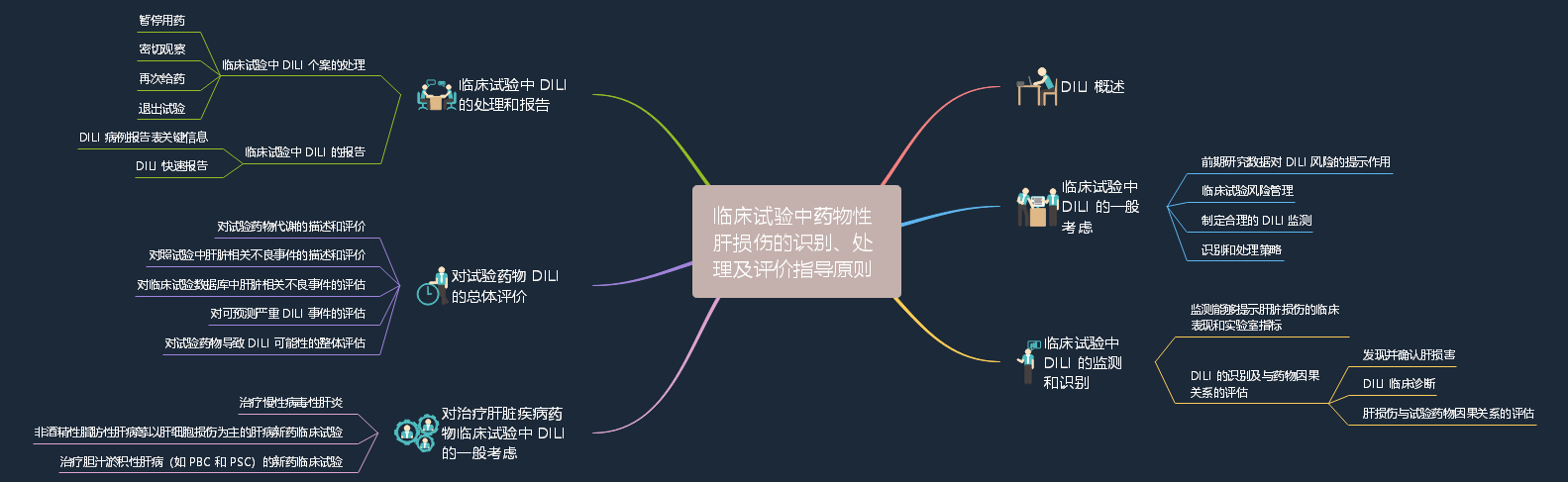
1、关于公开征求《临床试验中药物性肝损伤的识别、处理及评价指导原则》意见的通知
1.1.定义:药物性肝损伤(Drug-Induced Liver Injury,DILI)是指由各类化学药品、生物制品、传统中药及其代谢产物乃至辅料等所诱发的肝脏损伤。
1.2.适用范围:本指导原则适用于化学药品和生物制品。
1.3.主要内容:本指导原则提出了 DILI 的监测、评估及处理程序框架,主要用于指导药物临床试验中 DILI 风险的临床评价。仅作为推荐性建议。主要包括 DILI 概述,临床试验中 DILI 的一般考虑,临床试验中 DILI 的监测和识别,临床试验中 DILI的处理和报告,对试验药物 DILI 的总体评价,以及对治疗肝脏疾病药物临床试验中 DILI 的一般考虑。(详细内容见导图)
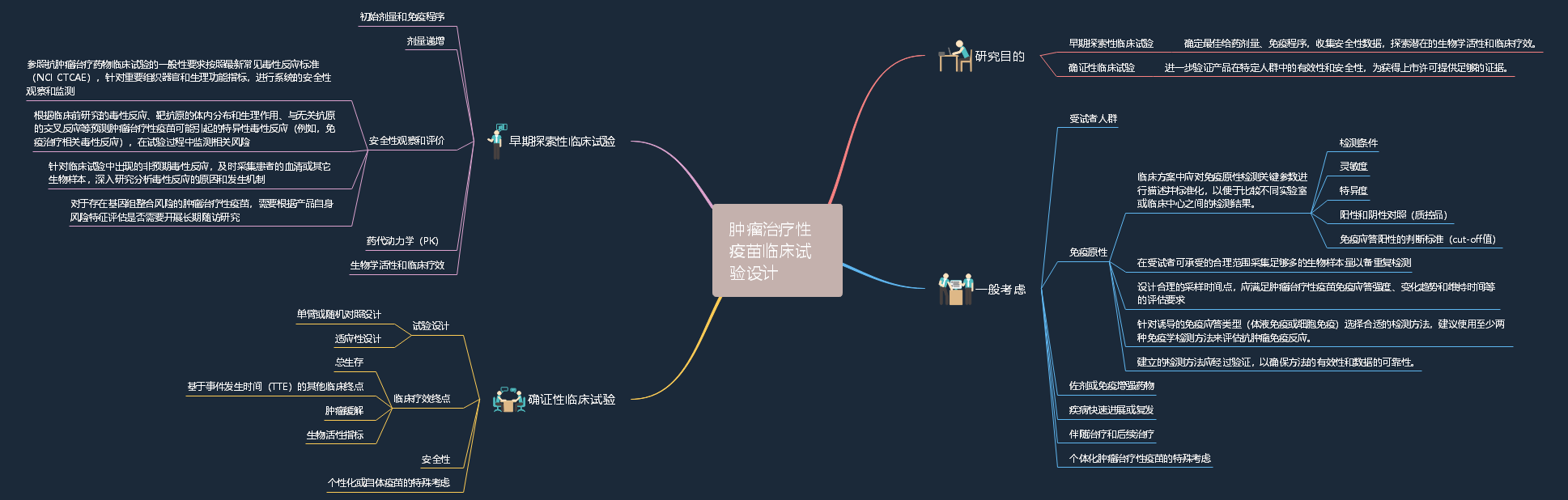
2、关于公开征求《肿瘤治疗性疫苗临床试验技术指导原则(征求意见稿)》意见的通知
2.1.定义:肿瘤治疗性疫苗是指通过诱导或增强机体针对肿瘤抗原的特异性主动免疫反应,从而达到控制和杀伤肿瘤细胞、清除微小残留病灶以及建立持久的抗肿瘤记忆等治疗目的一类产品。
2.2.适用范围:本指南不适用于预防和治疗传染病的疫苗、诱导或增强非特异性免疫反应的产品、预防或降低无既往同种肿瘤病史患者的肿瘤发病率的产品以及直接靶向杀伤肿瘤细胞的过继性免疫治疗产品(如T细胞或NK细胞产品)。
2.3.主要内容:第一个章节概述,主要介绍了本技术指导原则起草的背景、目的以及适用范围,同时明确了本指导原则为建议性而非强制性,并且其中的观点是阶段性的。第二个章节是临床试验设计的整体研发策略,分为一般考虑、早期探索性临床试验和确证性临床试验。(详细内容见导图)
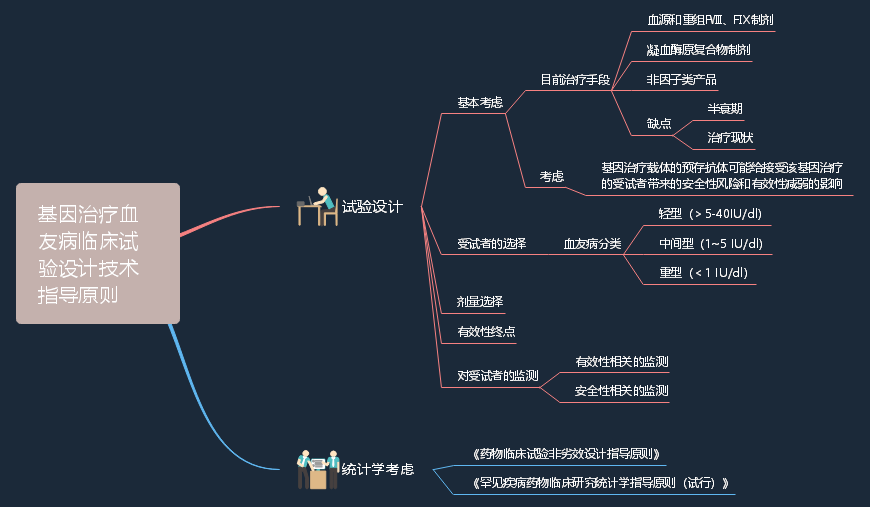
3、关于公开征求《基因治疗血友病临床试验设计技术指导原则(征求意见稿)》意见的通知
3.1.定义:血友病是一种X染色体连锁的隐性遗传性出血性疾病,由凝血因子基因突变引起,根据缺乏凝血因子的种类,主要为血友病A(凝血因子Ⅷ缺乏)和血友病B(凝血因子Ⅸ缺乏)。
3.2.主要内容:本指导原则的主要内容分为四个部分,分别是概述、试验设计、统计学考虑、参考文献。试验设计分为五个部分:基本考虑、受试者的选择、剂量选择、有效性终点、对受试者的监测。(详细内容见导图)
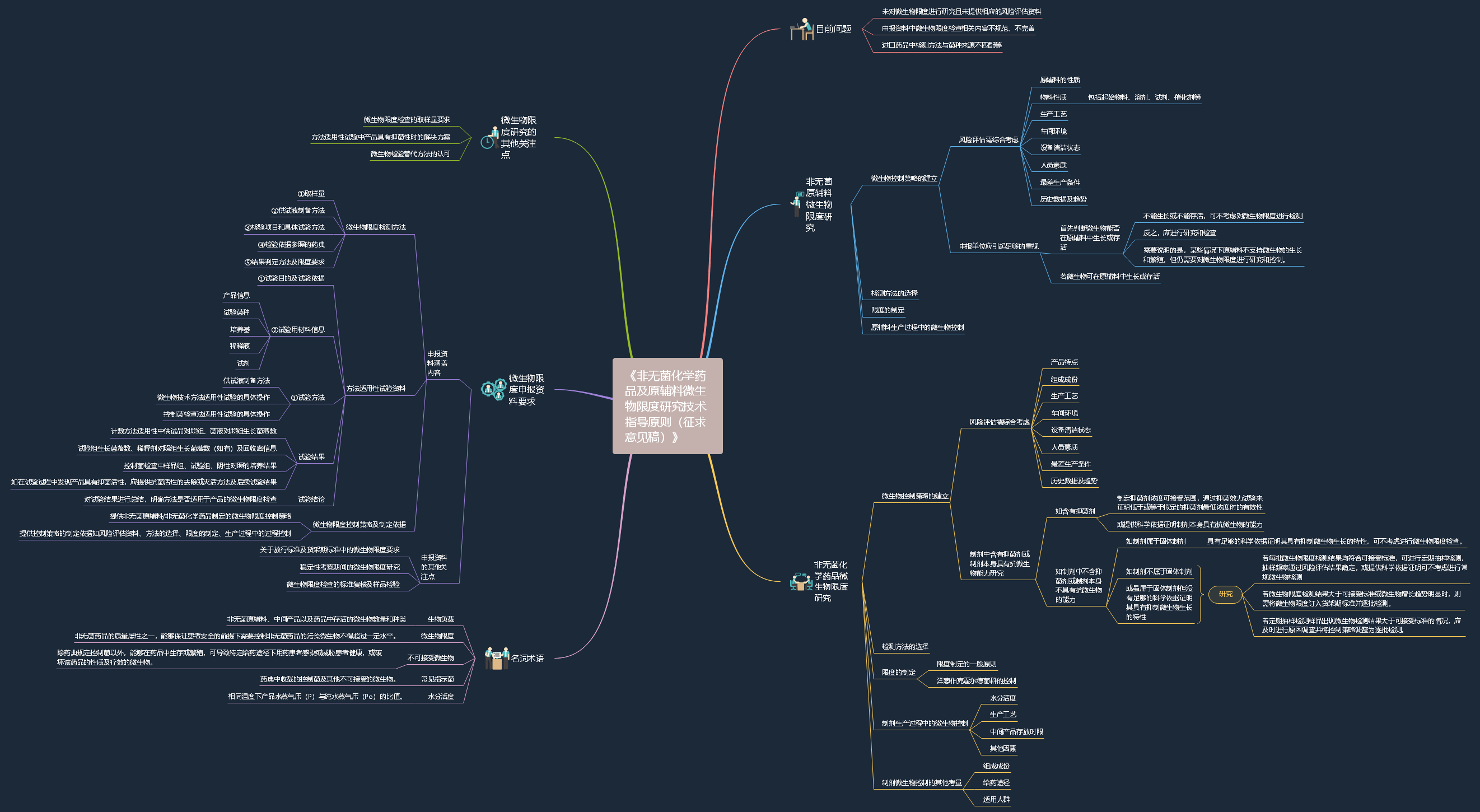
4、关于公开征求《非无菌化学药品及原辅料微生物限度研究技术指导原则(征求意见稿)》意见的通知
4.1.目前问题:目前在非无菌化学药品及原辅料申报过程中主要存在以下问题:未对微生物限度进行研究且未提供相应的风险评估资料;申报资料中微生物限度检查相关内容不规范、不完善,进口药品中检测方法与菌种来源不匹配等。上述问题对产品质量控制和评价以及后续质量标准复核可能产生较大影响。
4.2.主要内容:本指导原则主要内容包括概述、非无菌原辅料微生物限度研究、非无菌化学药品微生物限度研究、微生物限度研究的其他关注点、微生物限度申报资料要求、名词术语及参考文献七个部分。(详细内容见导图)
二、指导原则发布通知
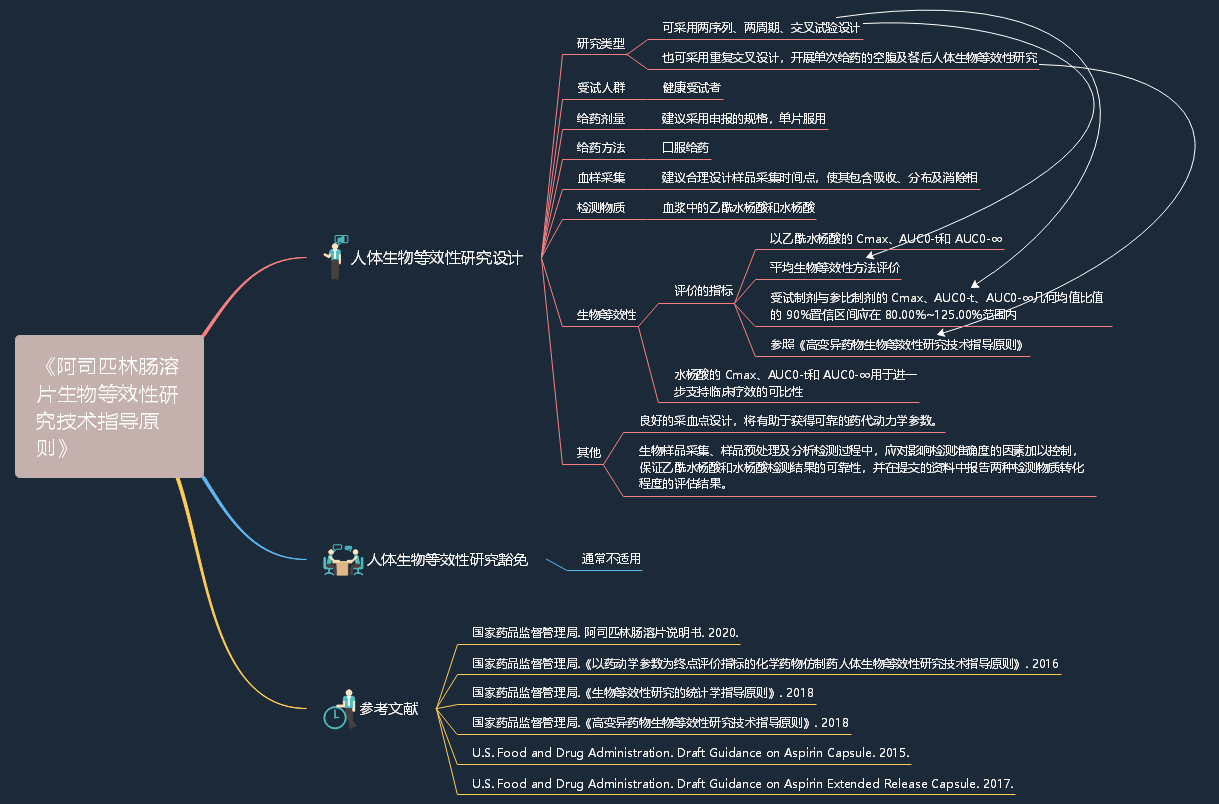
国家药监局药审中心关于发布《阿司匹林肠溶片生物等效性研究技术指导原则》的通告
定义:阿司匹林肠溶片(Aspirin enteric-coated tablets)是一种延迟释放制剂,其主要成份乙酰水杨酸在吸收前、吸收期间和吸收后,可转化成主要代谢产物水杨酸,代谢产物主要经肾脏途径排泄。
三、仿制药参比制剂发布
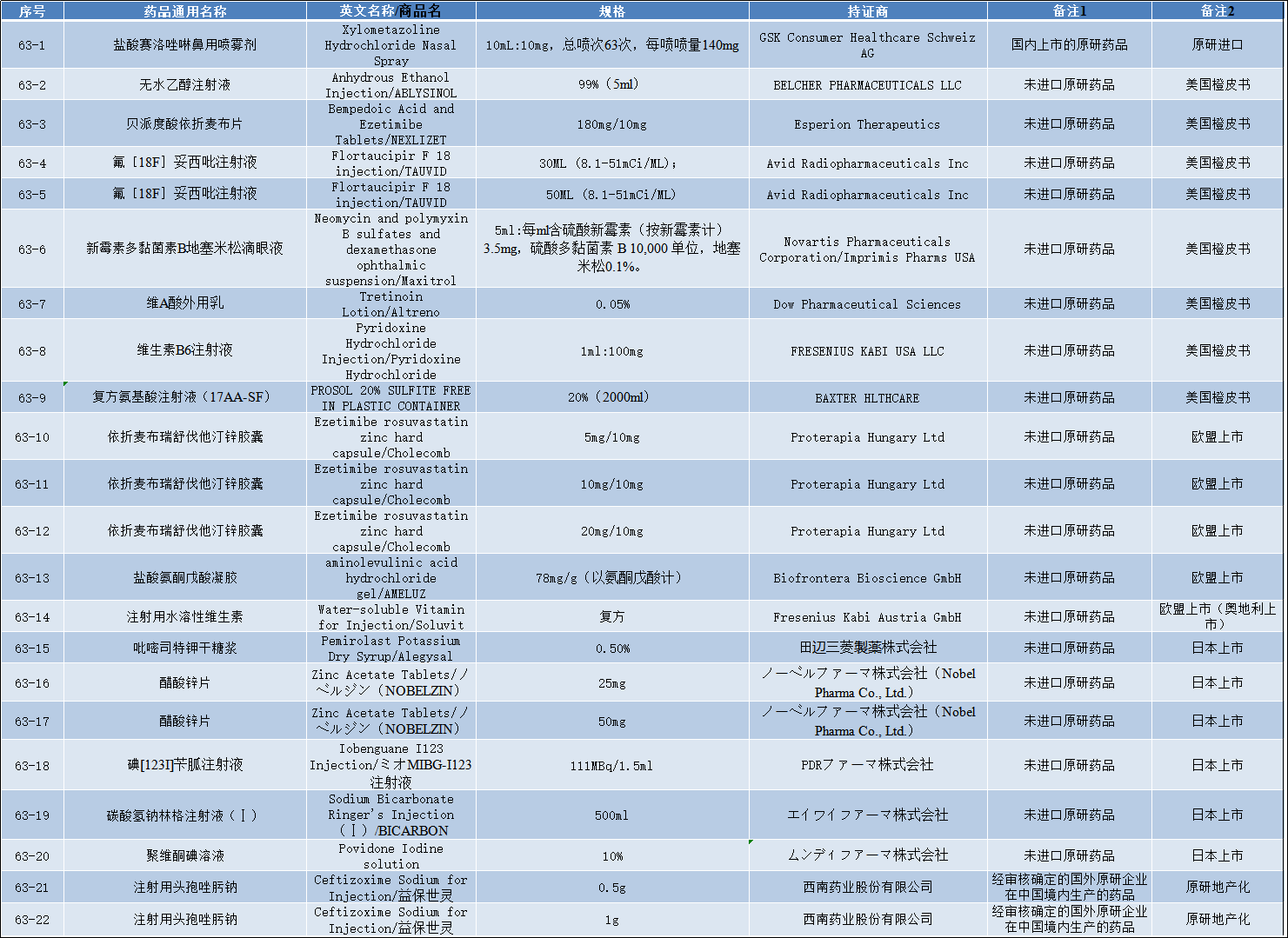
关于公开征求《化学仿制药参比制剂目录(第六十三批)》(征求意见稿)意见的通知
2022-10-09 药审中心组织遴选了第六十二批参比制剂,现予以公示征求意见。公示期限:2022年10月9日~2022年10月20日(10个工作日)
四、电子证书在相关证件中的应用
1.国家药监局关于发放药品电子注册证的公告
自2022年11月1日起,国家药监局发放药品电子注册证。公告内容如下:
1.1.发放范围:自2022年11月1日起,由国家药监局批准的药物临床试验、药品上市许可、药品再注册、药品补充申请、中药品种保护、进口药材、化学原料药等证书以及药物非临床研究质量管理规范认证证书。
1.2.法律效力:药品电子注册证与纸质注册证具有同等法律效力。电子证照具有即时送达、短信提醒、证照授权、扫码查询、在线验证、全网共享等功能。
1.3.查询方式:药品上市许可持有人或申请人须先行在国家药监局网上办事大厅注册并实名认证,进入网上办事大厅“我的证照”栏目,查看下载相应的药品电子注册证。也可登录“中国药监APP”,查看使用电子注册证。
1.4.附件查询:药品电子注册证不包含药品生产工艺、质量标准、说明书和标签等附件。上述附件以电子文件形式和药品电子注册证同步推送至国家药监局网上办事大厅法人空间“我的证照”栏目,推送成功即送达,药品上市许可持有人或申请人可自行登录下载获取。
1.5.注意事项:药品上市许可持有人或申请人应妥善保管国家药监局网上办事大厅账号、电子注册证及相关附件电子文件等。
1.6.其他问题:药品电子注册证使用相关问题可查看国家药监局网上办事大厅“电子证照常见问题解答”栏目。
2.国家药监局关于启用生物制品批签发电子证明、麻醉药品和精神药品实验研究立项电子批件的公告
自2022年11月1日起,对签发的生物制品批签发证明、麻醉药品和精神药品实验研究立项批件启用电子证照。实行电子证照后,推送成功即送达,原则上不再发放纸质证照。
2.1.法律效力:生物制品批签发电子证明、麻醉药品和精神药品实验研究立项电子批件与纸质证照具有同等法律效力。
2.2.功能有点:电子证明及电子批件具有即时送达、短信提醒、证照授权、扫码查询、在线验证、全网共享等功能。
2.3.注意事项:申请人须先行在国家药监局网上办事大厅注册并实名认证,妥善保管相关账号、电子证明及电子批件。
2.4.获取方式:申请人可进入网上办事大厅法人空间“我的证照”栏目,也可登录“中国药监APP”,查看下载相应的电子证明及电子批件。
2.5.疑难解答:常见电子证照问题解答可查看国家药监局网上办事大厅“电子证照常见问题解答”栏目。
五、产品上市
1、药品上市:
1.1.国家药监局批准多格列艾汀片上市
2022-10-08 国家药品监督管理局发布批准华领医药技术(上海)有限公司申报的1类创新药多格列艾汀片(商品名:华堂宁)上市。该药品适用于改善成人2型糖尿病患者的血糖控制。多格列艾汀是葡萄糖激酶(GK)激活剂,作用于胰岛、肠道内分泌细胞以及肝脏等葡萄糖储存与输出器官中的葡萄糖激酶靶点,改善2型糖尿病患者血糖稳态失调。该药品的上市为2型糖尿病患者提供了新的治疗选择。
1.2.国家药监局批准散寒化湿颗粒上市
2022-10-09 国家药品监督管理局发布批准3.2类中药新药散寒化湿颗粒上市。该药品用于寒湿郁肺所致疫病。药品上市许可持有人为江苏康缘药业股份有限公司。该品种上市为疫病的治疗提供了又一种治疗选择。
2、器械上市
颅内动脉瘤手术计划软件获批上市
2022-10-11 国家药品监督管理局经审查,发布批准了强联智创(北京)科技有限公司生产的“颅内动脉瘤手术计划软件”创新产品注册申请。该产品由应用程序和授权文件组成,软件功能模块包括数据加载、显示交互、数据管理、数据处理和日志。产品用于脑血管病患者X射线血管造影三维体层图像的显示、分割、测量和处理,辅助医生在神经介入手术时进行动脉瘤弹簧圈栓塞用的微导管路径和塑形规划。该产品利用医学图像处理技术对颅内动脉瘤患者的X射线血管造影三维体层图像进行处理,实现三维血管重建、动脉瘤分割和自动测量及微导管路径和塑形针形状规划,帮助医生进行术前方案规划。与传统神经介入手术方式相比,该产品可以提升微导管一次性到位率,缩短微导管输送时间,降低术中微导管反复推送对血管刺激导致的并发症发生概率,减少医生、患者X射线辐射时间。

