2022年9月法规数量
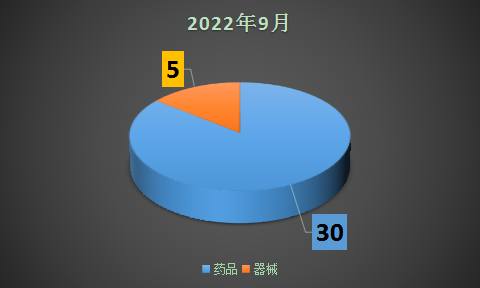
一、药品板块
本月药品板块共分征求和通知公告两块内容,其中征求内容包括12篇指导原则;通知公告包括标准、参比制剂、处转非、检查公告、药包材、上市情况、说明书、对照品停用、指导原则试行及其它。
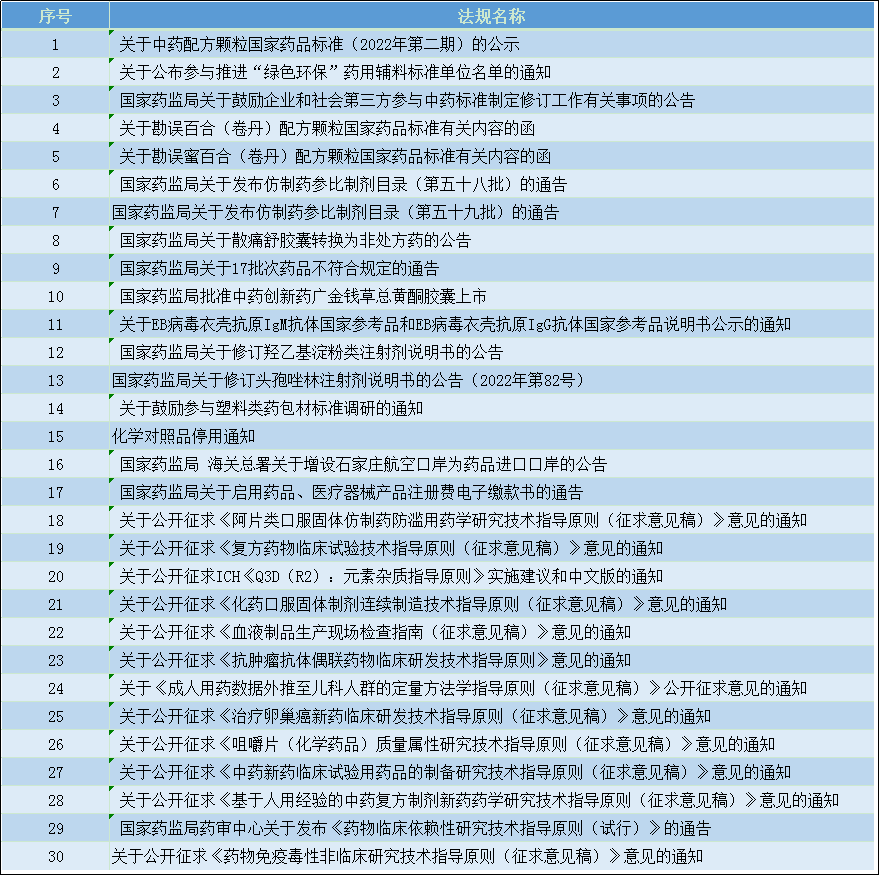
1、征求内容
1.1.征求指导原则
2022-09-05 关于公开征求《阿片类口服固体仿制药防滥用药学研究技术指导原则(征求意见稿)》意见的通知
阿片类药物的滥用已在全球范围内成为日益严重的公共卫生问题,采用防滥用技术的阿片类药物可以降低临床滥用风险。为了鼓励申请人开发具有防滥用特性的阿片类口服固体仿制药,也为了统一技术审评尺度,药审中心组织起草了《阿片类口服固体仿制药防滥用药学研究技术指导原则(征求意见稿)》,现向社会各界征求意见。征求意见时限为自发布之日起1个月。
2022-09-07 关于公开征求《复方药物临床试验技术指导原则(征求意见稿)》意见的通知
复方药物是指含有两种或两种以上已知活性成份的药物。复方药物是改良型新药的一种重要类型,其临床研发具有特殊性。复方药物临床试验的设计取决于复方的立题和治疗目标。复方药物的研发涉及不同适应症领域、不同疾病和活性成分的特性,但其临床研发具有共性的技术考虑。为了科学引导企业合理地开发复方药物,进一步明确临床试验技术标准,药审中心起草了《复方药物临床试验技术指导原则(征求意见稿)》,经中心内部讨论,已形成征求意见稿。征求意见时限为自发布之日起1个月。
2022-09-08 关于公开征求ICH《Q3D(R2):元素杂质指导原则》实施建议和中文版的通知
为推动新修订的ICH指导原则在国内的平稳落地实施,我中心拟定了《Q3D(R2):元素杂质指导原则》实施建议,同时组织翻译中文版。现对Q3D(R2)实施建议和中文版公开征求意见,为期1个月。

2022-09-09 关于公开征求《化药口服固体制剂连续制造技术指导原则(征求意见稿)》意见的通知
为了鼓励创新和制药现代化,助力ICH Q13指导原则在国内的落地实施,同时也为了指导企业研发,统一审评尺度,药审中心组织起草了《化药口服固体制剂连续制造技术指导原则(征求意见稿)》,现向社会各界征求意见,征求意见时限为自发布之日起1个月。
本指导原则主要内容包括:概述、总体考虑、相关概念、控制策略、工艺验证、稳定性研究、批量变更、药品质量体系、申报资料要求、参考文献共十部分。
本指导原则的起草,借鉴了国外相关指导原则及标准,阐明了化药口服固体制剂连续制造的基本考虑,相关要求与ICH Q13 的基本原则和理念保持一致。申请人在研究过程中,可一并参照 ICH Q13 及其他相关指导原则,加强对连续制造相关概念的理解,基于科学的研究方法,建立有效的连续制造的控制策略。
本指导原则适用于化药口服固体制剂的连续制造。
本指导原则所述的连续制造工艺通常适用于两个或两个以上固体单元操作直接相连组成的整合工艺。
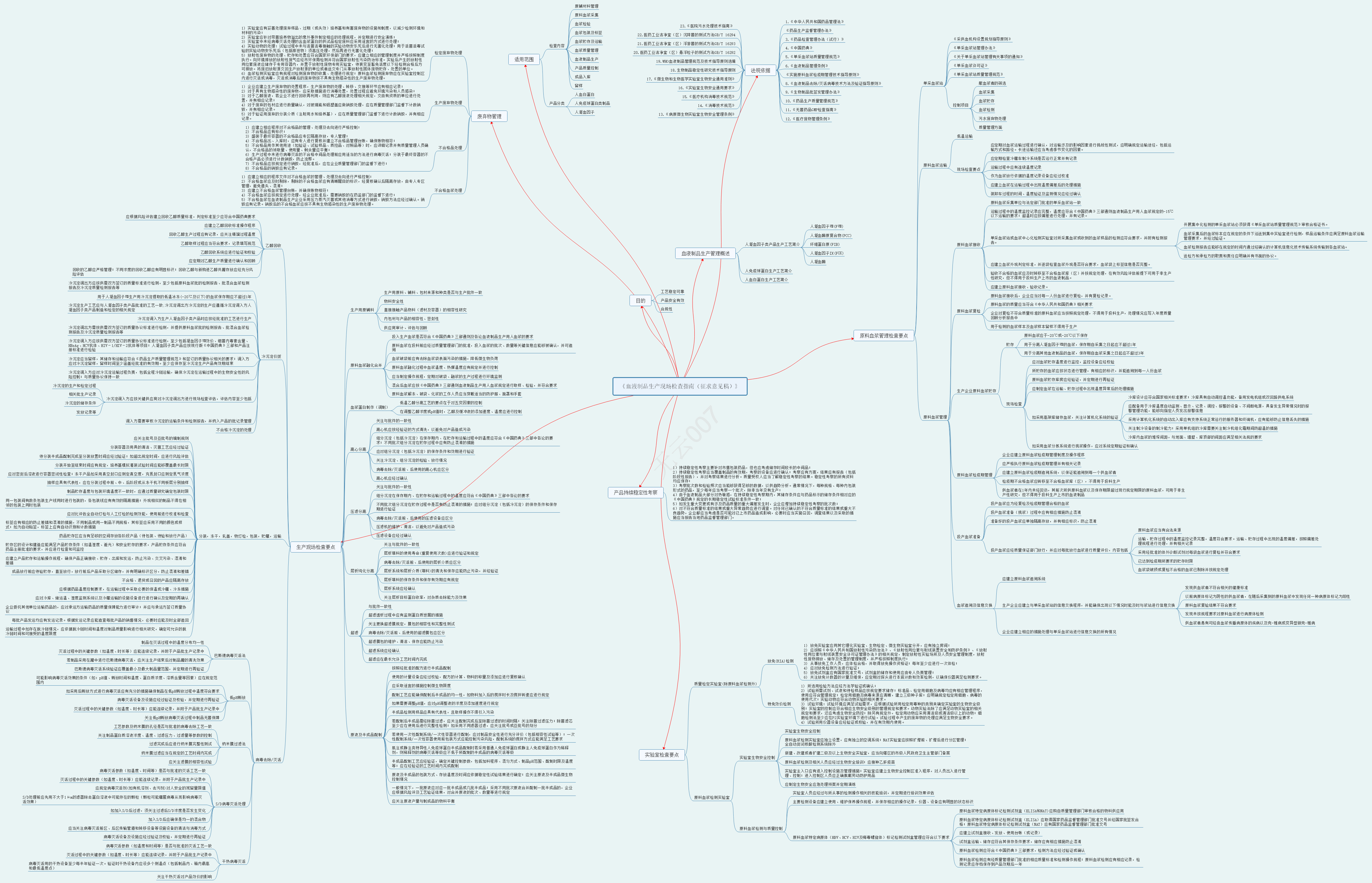
2022-09-14 关于公开征求《血液制品生产现场检查指南(征求意见稿)》意见的通知
为指导血液制品生产现场检查工作,加强对血液制品生产企业的监督管理,核查中心组织研究起草了《血液制品生产现场检查指南(征求意见稿)》,现向社会公开征求意见。请于2022年9月30日前,将意见和建议反馈我中心。
2022-09-15 关于公开征求《抗肿瘤抗体偶联药物临床研发技术指导原则》意见的通知
生物制药技术的发展,推动抗体偶联药物进入高速发展阶段,尤其是在肿瘤治疗领域,抗体偶联抗肿瘤药物的研发持续增长。为了对抗体偶联抗肿瘤药物的临床研发中需要特殊关注的问题提出建议,并指导企业开展更为科学的临床研发,药品审评中心组织撰写了《抗肿瘤抗体偶联药物临床研发技术指导原则》,形成征求意见稿,供药物研发相关人员参考。征求意见时限为自发布之日起1个月。
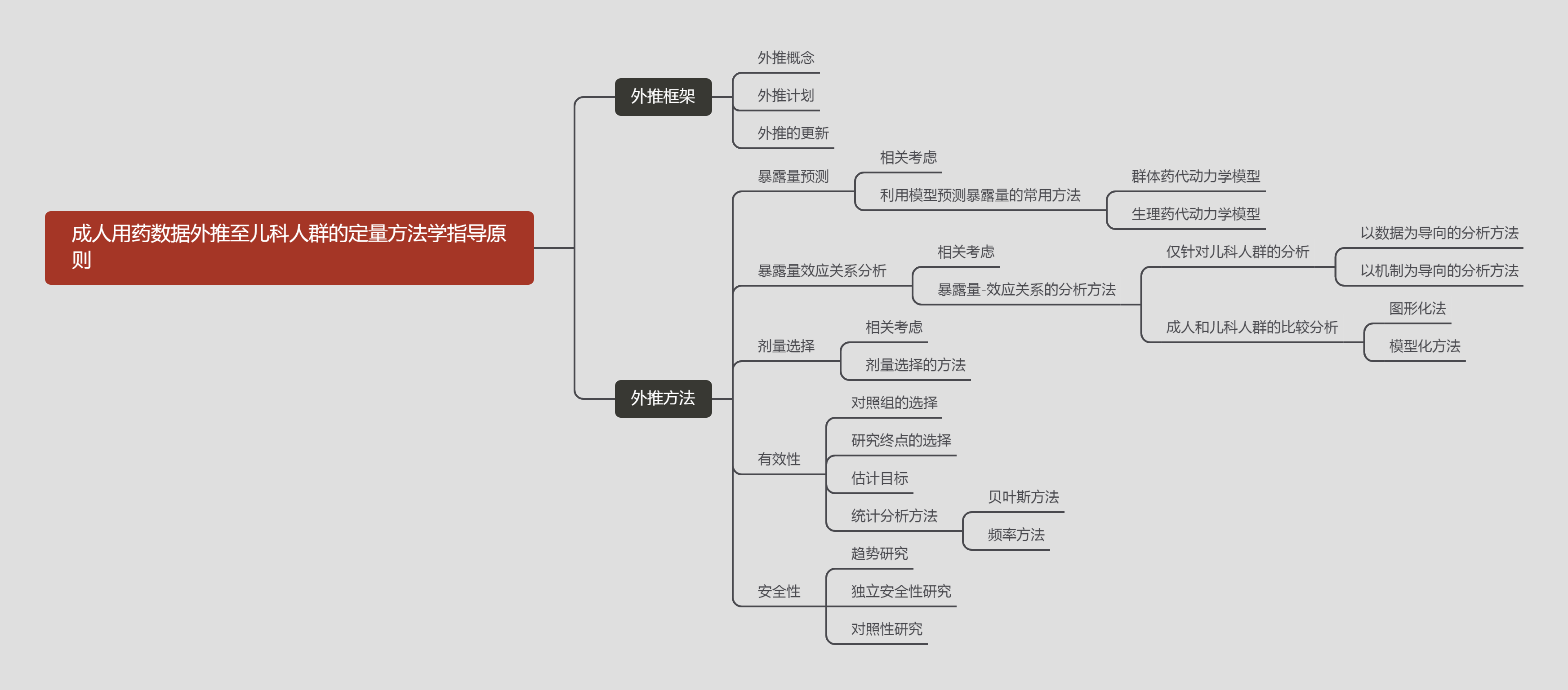
2022-09-19 关于《成人用药数据外推至儿科人群的定量方法学指导原则(征求意见稿)》公开征求意见的通知
为促进和指导儿科药物研发,药审中心组织起草了《成人用药数据外推至儿科人群的定量方法学指导原则(征求意见稿)》,现公开征求意见,征求意见时限为自发布之日起1个月。
2022-09-26 关于公开征求《治疗卵巢癌新药临床研发技术指导原则(征求意见稿)》意见的通知
现阶段国内尚无治疗卵巢癌新药临床研发相关技术指导原则,现有的指导原则尚不能涵盖和专门针对卵巢癌的临床试验设计的考虑,为进一步明确技术原则,提高新药研发效率,化药临床一部相关适应症小组组织撰写了《治疗卵巢癌新药临床研发技术指导原则》,形成征求意见稿,供药物研发相关人员参考,征求意见时限为自发布之日起1个月。
2022-09-26 关于公开征求《咀嚼片(化学药品)质量属性研究技术指导原则(征求意见稿)》意见的通知
为明确对咀嚼片(化学药品)质量属性研究的技术要求,以更好地指导企业进行研究以及统一监管要求,药审中心经调研以及与专家和业界讨论,组织起草了《咀嚼片(化学药品)质量属性研究技术指导原则(征求意见稿)》,征求意见时限为自发布之日起1个月。
2022-09-27 关于公开征求《中药新药临床试验用药品的制备研究技术指导原则(征求意见稿)》意见的通知
为加快建立和完善符合中药特点的技术评价体系,促进基于我国中药新药研发创新,药审中心起草了《中药新药临床试验用药品的制备研究技术指导原则》,现在中心网站予以公示,征求意见时限为自发布之日起一个月。
2022-09-27 关于公开征求《基于人用经验的中药复方制剂新药药学研究技术指导原则(征求意见稿)》意见的通知
为加快建立和完善符合中药特点的技术评价体系,促进基于人用经验的中药复方制剂新药的研发注册,药审中心起草了《基于人用经验的中药复方制剂新药药学研究技术指导原则》,现在中心网站予以公示,征求意见时限为自发布之日起一个月。
2022-09-30 关于公开征求《药物免疫毒性非临床研究技术指导原则(征求意见稿)》意见的通知
近年来,随着大量免疫相关治疗药物研发申报涌现,药物对免疫系统的安全性已成为一个备受瞩目的问题。现有ICH S8指导原则主要针对化学药物,不包含生物制品。国内目前尚无较为全面的针对化药和生物制品免疫毒性的指导原则。为更好地引导药物研发过程中对潜在免疫毒性的评价,药品审评中心组织撰写了《药物免疫毒性非临床研究技术指导原则》,现形成征求意见稿,征求意见时限为自发布之日起1个月。
2、通知公告
2.1.标准
2022-09-07 药典委通知各省、自治区、直辖市药品监督管理局:“蜜百合(卷丹)配方颗粒”国家标准,标准号为YBZ-PFKL-2021089,已于2021年11月1日正式执行,经药典委核查,对其标准在【特征图谱】、【含量测定】项中6处对照品“王百合苷B”名称进行勘误,应为“2-乙酰王百合苷A”。
2022-09-07 药典委通知各省、自治区、直辖市药品监督管理局:“百合(卷丹)配方颗粒”国家标准,标准号为YBZ-PFKL-2021007,已于2021年11月1日正式执行,经药典委核查,对其标准在【特征图谱】、【含量测定】项中6处对照品“王百合苷B”名称进行勘误,应为“2-乙酰王百合苷A”。
2022-09-06 为进一步提升中药标准管理能力,建立最严谨的标准,优化标准工作机制,全面构建政府引导、企业为主、社会参与、开放融合的中药标准工作新格局,充分发挥社会力量在标准工作中的重要作用,国家局现鼓励企业和社会第三方参与中药标准制定修订工作。
2022-09-01 按照国家药品监督管理局统一部署要求,根据国家药品标准工作程序,药典委组织相关企业开展中药配方颗粒国家药品标准研究,形成了2022年第二期19个中药配方颗粒拟公示标准。
涉及主要产品有:布渣叶配方颗粒、醋南五味子配方颗粒、醋五味子配方颗粒、大蓟配方颗粒、鹅不食草配方颗粒、姜黄配方颗粒、筋骨草配方颗粒、酒白芍配方颗粒、酒续断配方颗粒、龙胆(坚龙胆)配方颗粒、龙脷叶配方颗粒、玫瑰花配方颗粒、南五味子配方颗粒、青蒿配方颗粒、山银花(灰毡毛忍冬)配方颗粒、石韦(有柄石韦)配方颗粒、熟大黄(掌叶大黄)配方颗粒、五味子配方颗粒、仙鹤草配方颗粒。
2.2.参比制剂
2022-09-22 国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,发布仿制药参比制剂目录(第五十九批)。
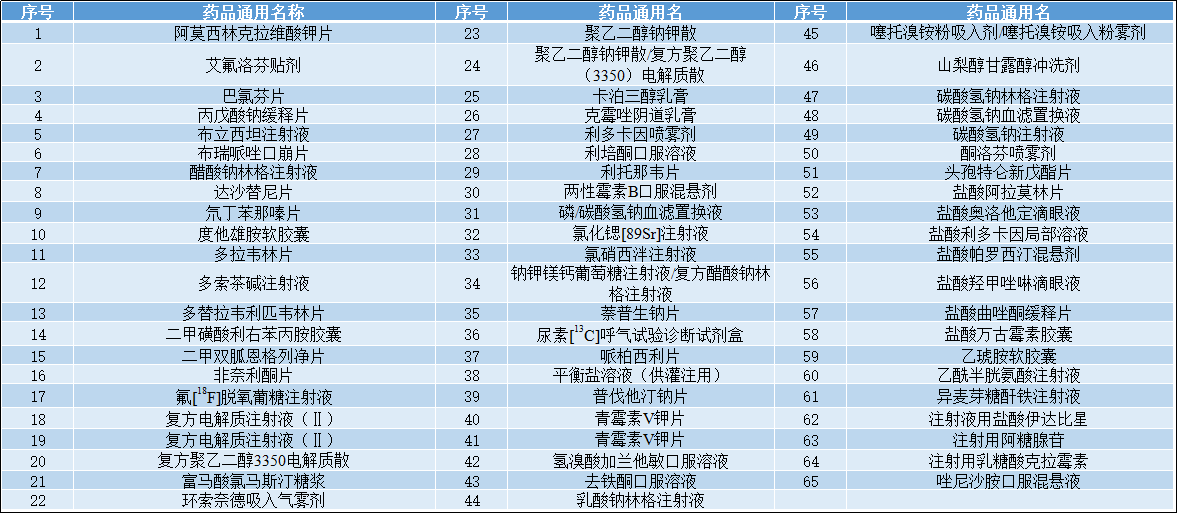
2022-09-14 国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第五十八批)。
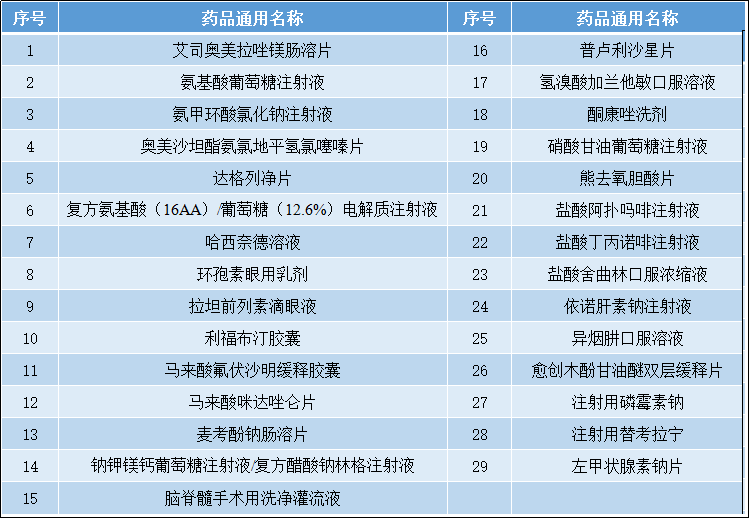
2.3.处转非
2022-09-20 国家局根据《处方药与非处方药分类管理办法(试行)》(原国家药品监督管理局令第10号)的规定,批准散痛舒胶囊由处方药转换为非处方药。相关药品上市许可持有人在2023年6月15日前,依据《药品注册管理办法》等有关规定就修订说明书事项向省级药品监督管理部门备案,并将说明书修订的内容及时通知相关医疗机构、药品经营企业等单位。非处方药说明书范本规定内容之外的说明书其他内容按原批准证明文件执行。药品标签涉及相关内容的,应当一并修订。自备案之日起生产的药品,不得继续使用原药品说明书。
2.4.检查公告
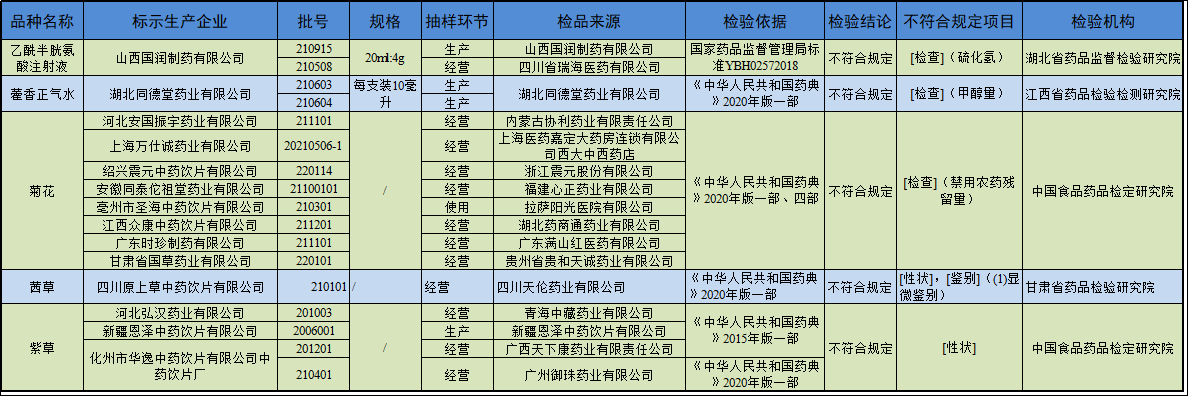
经湖北省药品监督检验研究院等4家药品检验机构检验,标示为山西国润制药有限公司等14家企业生产的乙酰半胱氨酸注射液等17批次药品不符合规定。
2.5.药包材
2022-09-06 国家药典委员会委托有关单位牵头起草《中国药典》塑料类药包材通用技术要求,现拟对部分产品的材料、工艺、检验检测等信息进行调研,以便结合调研情况开展标准制订工作。请相关单位按要求填写调研表,并于2022年10月15日前,将调研表WORD版和盖章后的扫描件电子版一并以电子邮件的方式反馈至联系人。同时,为增强药包材标准研究用样品的代表性,补充征集部分研究用样。请相关单位配合提供符合要求的样品及有关资料,并于2022年10月15日前邮寄或直接送至“样品寄送地址”。
2.6.上市情况
2022-09-15 国家药品监督管理局发布批准了1.2类中药创新药广金钱草总黄酮胶囊的上市注册申请。该药的主要成份是从广金钱草中提取得到的总黄酮类成份,药品上市许可持有人为武汉光谷人福生物医药有限公司。该药开展了随机、双盲、安慰剂平行对照、多中心临床试验,临床试验研究结果显示与安慰剂对照组间比较有统计学差异,可用于输尿管结石中医辨证属湿热蕴结证患者的治疗。该品种上市将为临床相关疾病的患者提供新的治疗选择。药品监督管理部门将加强该药品上市后监管,保护患者用药安全。
2.7.说明书
2022-09-06 根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对羟乙基淀粉类注射剂(包括羟乙基淀粉20氯化钠注射液、羟乙基淀粉40氯化钠注射液、高渗氯化钠羟乙基淀粉40注射液、羟乙基淀粉200/0.5氯化钠注射液、高渗羟乙基淀粉200/0.5氯化钠注射液、羟乙基淀粉130/0.4氯化钠注射液、羟乙基淀粉130/0.4电解质注射液)说明书内容进行统一修订。
上述药品的上市许可持有人均应依据《药品注册管理办法》等有关规定,按照羟乙基淀粉类注射剂说明书修订要求,于2022年12月2日前报国家药品监督管理局药品审评中心或省级药品监督管理部门备案。
修订内容涉及药品标签的,应当一并进行修订,说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换。
2022-09-05 中检院已完成EB病毒衣壳抗原IgM抗体国家参考品和EB病毒衣壳抗原IgG抗体国家参考品的研制,现就说明书内容向社会公示并征求意见。请于2022年9月10日前将意见反馈至中检院诊断试剂所。
2022-09-30 根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对头孢唑林注射剂(包括注射用头孢唑林钠、注射用头孢唑林钠/氯化钠注射液)说明书内容进行统一修订。药品上市许可持有人于2022年12月30日前报国家药品监督管理局药品审评中心或省级药品监督管理部门备案。修订内容涉及药品标签的,应当一并进行修订,说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换。
2.8.对照品停用
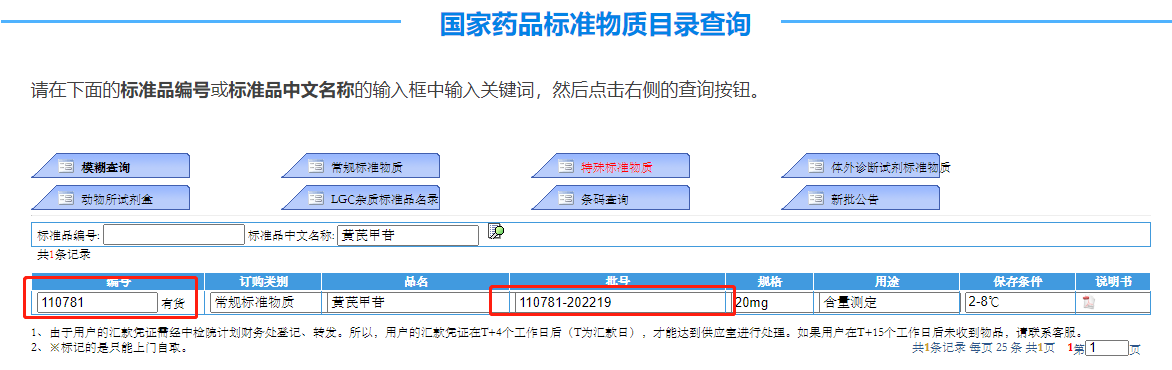
2022-09-28,中检院通知停用110781-202118 黄芪甲苷对照品,目前该对照品最新批号为:110781-202219。
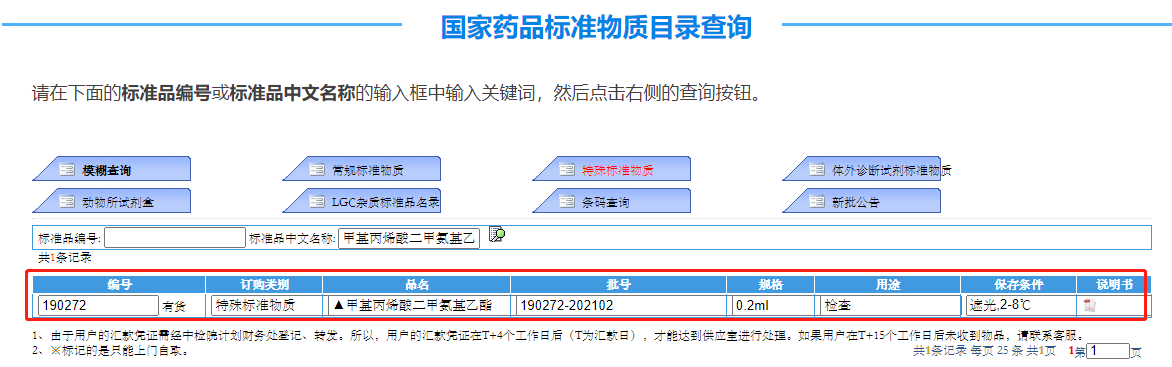
2022-09-27,中检院通知停用190272-202001 甲基丙烯酸二甲氨基乙酯对照品,目前该对照品最新批号为:190272-202102。
2.9.指导原则试行
2022-09-28 国家药监局药审中心关于发布《药物临床依赖性研究技术指导原则(试行)》的通告
药物临床依赖性研究是具有潜在滥用风险的新药上市前的重要研究内容,我国尚无专门技术要求对此类研究进行规范管理。在国家药品监督管理局的部署下,药审中心组织制定了《药物临床依赖性研究技术指导原则(试行)》,自发布之日起施行。
该指导原则主要内容规定了研究对象、研究时机、研究方法和说明书撰写要求,其中研究方法包括:滥用相关不良事件收集、认知和行为测试、躯体依赖性(戒断反应)评估、人类滥用潜力研究。人类滥用潜力研究主要包括:实施条件、受试者、研究设计、评估指标、统计分析。
2.10.其它
2022-09-01 根据《中华人民共和国药品管理法》,经国务院批准,同意增设石家庄航空口岸为药品进口口岸。
2022-09-02 根据财政部关于稳步推广电子非税收入一般缴款书工作要求,国家药监局决定启用药品、医疗器械产品注册费电子缴款书。一、申请人在国家药品监督管理局网上办事大厅提交药品、医疗器械产品注册申请,相关审评中心将进行审核,确认无误后财政部非税收入收缴管理系统将以短信形式向申请人发送电子缴款码,申请人可通过柜台缴款、自助终端、网上缴款、自助POS刷卡、银行汇兑、划缴缴款等方式进行缴款。国家药品监督管理局行政事项受理服务和投诉举报中心确认应缴费用到账后,将于10个工作日内将电子缴款书发送至申请人指定的电子邮箱。二、电子缴款书与纸质票据具有同等法律效力。三、电子缴款书自本通告发布之日起正式启用。
二、器械板块
本月器械板块内容包括标准发布、产品上市、产品注销、猴痘检测、器械监管和通知公告。观察最近两月相关器械信息,器械行业的标准修订和发布是目前的重要工作,另外产品上市和注销的发布也较之前有所频繁。

1.产品上市
2022-09-16 国家药品监督管理局发布2022年9月共批准注册医疗器械产品210个。其中,境内第三类医疗器械产品161个,进口第三类医疗器械产品25个,进口第二类医疗器械产品22个,港澳台医疗器械产品2个。
2022-09-20 国家药品监督管理局经审查,发布批准了山东吉威医疗制品有限公司生产的创新产品“优美莫司涂层冠状动脉球囊扩张导管”注册。优美莫司涂层冠状动脉球囊扩张导管由球囊扩张导管及球囊上的药物涂层组成,球囊导管由球囊、远端管、过渡管和近端管等组成。药物涂层含有优美莫司和聚环氧乙烷载体,药物剂量为3μg/mm2。产品经环氧乙烷灭菌,一次性使用。该产品通过聚环氧乙烷载体将优美莫司药物粘附在球囊表面,聚环氧乙烷的亲水特性和优美莫司的亲脂特性使药物可以从球囊表面释放并快速进入血管壁。药物球囊作为一种血管内药物释放技术,能在病变部位释放有效治疗浓度的药物,解决并治疗冠心病介入及支架内再狭窄病变。该产品适用于血管直径2.0mm-2.75mm原发冠状动脉血管病变治疗,为原发小血管病变患者提供了新的选择。药品监督管理部门将加强该产品上市后监管,保护患者用械安全。
2022-09-26 国家药品监督管理局发布批准了上海艾普强粒子设备有限公司生产的“质子治疗系统”创新产品注册申请。该产品是“十三五”期间科技部重点研发计划“数字诊疗装备专项”的重点支持项目,也是我国首台获准上市的国产质子治疗系统。该产品的获批上市,标志着我国高端医疗器械装备国产化又迈出一步,对于提升我国医学肿瘤诊疗手段和水平,具有重大意义。该产品由加速器系统和治疗系统两部分组成。其中加速器系统包括注入器系统、低能传输系统、主加速器系统、高能束流传输系统和辅助电气系统,治疗系统包括固定束治疗系统、180°旋转束治疗系统和治疗计划系统。产品提供质子束进行放射治疗,在实现肿瘤部位高剂量的同时,可降低周围正常组织剂量,特别是靶区后组织的剂量,适用于治疗全身实体恶性肿瘤和某些良性疾病,具体适应症应由临床医师根据实际情况确定。使用者应当严格按照产品批准的适用范围使用产品,同时应当严格遵守卫生健康部门的诊疗规范。在该产品的注册申报过程中,国家药监局按照“提前介入、专人负责、全程指导,科学审批”的原则,在标准不降低、程序不减少的前提下,积极沟通,多方协调,加大产品注册申报指导,加快审评审批进程,在保证安全、有效的基础上推动产品尽快上市,满足患者使用高水平医疗器械的需要。
2.器械监管
2022-09-23 为加强医疗器械监督管理,保障医疗器械产品质量安全有效,国家药品监督管理局组织对电动轮椅等12个品种进行了产品质量监督抽检,发现26批(台)产品不符合标准规定。被抽检项目不符合标准规定的医疗器械产品包括:电动轮椅3台、气腹机1台、金属脊柱棒1批次、金属接骨板1批次、Nd:YAG激光治疗机1台、妇科超声诊断设备1台、携带式X射线机1台、牙科种植机1台、一次性使用腹部穿刺器3批次、手术衣3批次、一次性使用人体静脉血样采集容器3批次、内窥镜用冷光源7台。
3.通知公告
2022-09-16 中检院办公室关于召开人类辅助生殖技术用医疗器械标准化技术归口单位专家组换届大会暨行业标准审定会的通知

2022-09-02 根据财政部关于稳步推广电子非税收入一般缴款书工作要求,国家药监局决定启用药品、医疗器械产品注册费电子缴款书。一、申请人在国家药品监督管理局网上办事大厅提交药品、医疗器械产品注册申请,相关审评中心将进行审核,确认无误后财政部非税收入收缴管理系统将以短信形式向申请人发送电子缴款码,申请人可通过柜台缴款、自助终端、网上缴款、自助POS刷卡、银行汇兑、划缴缴款等方式进行缴款。国家药品监督管理局行政事项受理服务和投诉举报中心确认应缴费用到账后,将于10个工作日内将电子缴款书发送至申请人指定的电子邮箱。二、电子缴款书与纸质票据具有同等法律效力。三、电子缴款书自本通告发布之日起正式启用。

