COVID 19已然三年,官方对于海外药企的审计也更加依赖远程手段,单说FDA的远程审计指南,已然更新至二版。本文将从欧美官方出具的指南出发,浅谈FDA与EMA的远程审计。
1. 起源
FDA 2021 Apr指南

关注起草该法规的部门,分别是CDER, CBER 以及CVM,覆盖范围为化药、生物药和兽用药范畴(没有医疗器械)。关于FDA各部门具体职能不再赘述,部门架构见下图。
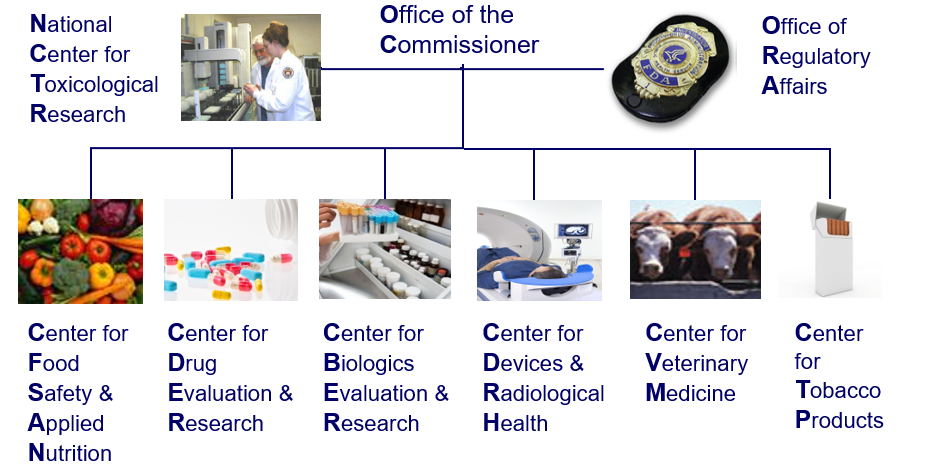
FDA部门架构简图
本指南FDA将该活动命名为Remote Interactive Evaluations (RIE)。与寻常的Inspection用词并不一致,所以在初期FDA非常谨慎地对待远程评估(这里尊重英文原意不再叫它审计)活动,且明确说明,RIE活动不会取代现场审计工作。FDA对于远程审计的触发,依然与现场审计类似,需要通过充分地风险评估后,给出需要审计的设施清单和其优先级。对于目前暂时不方便去现场的设施,FDA也会在情况允许后尽快恢复被推迟的现场检查。
在指南中,FDA也表明,在整个RIE的过程中,并不会出具Form FDA 482, Notice of Inspection或 Form FDA 483, Inspectional Observations。原文见下图
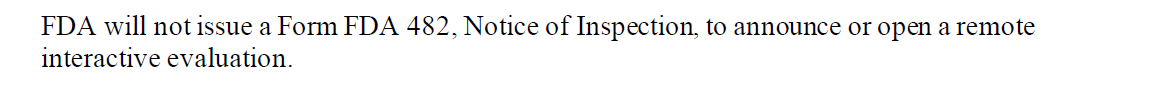
关于Form 482的说明

关于Form 483的说明
虽然官方嘴上说说,但在可能没人注意的角落,本指南最不吉利的注释13中轻描淡写地说了一下,虽然RIE要不了你的命,但是也只是暂时地。在后续触发的现场审计中,依然会把RIE中具的发现项加到483里。所以在对待远程审计时,也需要如指南所述,与现场审计同等对待。

注释13的说明,不愧于这个序号
很快,在今年七月份,FDA出具了升级版远程审计指南,提出了Remote Regulatory Assessment (RRA)活动。

可以看到,与仅CBER和CDER签署的RIE不同,RRA的覆盖范围是FDA的所有部门。看来三年之后又三年,FDA其他部门也发觉了远程工作指南的必要性。
在RIE的过程中,FDA主要有以下三大期望:
1. FDA希望可以审核相关的文件与记录。除纸质文件外,电子系统的记录,其他临床或者非临床学术研究的原始记录,都是FDA希望在RIE中访问的文件。
2.FDA希望被审计的企业建立一个虚拟的会议室,以便于企业提交信息和证据,并方便FDA访问电子系统、观察企业的生产操作,或审核其SOP。
3. FDA希望企业使用直播或者视频预录制的方式,在虚拟会议室中完成厂区的site tour。
作为先决条件,企业在收到RIE通知,或自发申请RIE时,要在RIE启动前完善自身的“硬件基础”,如:
1. 线上分享文档的电子平台(Sharepoint, OneDrive等)
2. 使用能与被检查的公司工作人员和SME实时讨论的电话或视频会议或其他工具(Teams, Zoom等)
3. 对于企业在用计算机系统,需为检查官提供远程登录权限,或至少可以远程共享屏幕给审计官。
4. 提供直播摄像头或视频记录(便携摄像机,无人机摄像头等)允许检察官远程检查生产操作,设施设备和相应的文件(如日志)
5. 搞明白和检查官的时差
6. 语言交流。如企业语言能力不充分,需提前准备翻译。对于部分关键文件,需要专人翻译,翻译人员在提供翻译件的同时,也需要上传对翻译内容确认真实的保证书。
以上是对于法规内容的初步摘要解读,后续再为诸位分享EMA远程审计的经历,未完待续…

