转发本文到朋友圈,添加微信 pckt6842免费领取【药品上市后变更及质量控制】思维导图
1、定义概述
1.1 变更定义
变更(Change/variation),是指对已获准上市化学药品在生产、质控、使用条件等诸多方面提出的涉及来源、方法、控制条件等方面的变化。这些变化可能影响到药品的安全性、有效性和质量可控性。
对企业来说,持续改进、与时俱进是生存和发展不可避免的,因此药品生产企业会在日常工作中常常希望进行各种各样的变更,变更意图常常由以下原因驱动:
1.2 变更细分
工艺变更
化学药物制剂生产工艺变更主要包括变更制剂生产过程及工艺参数、变更原料药内控标准/制剂中间体内控标准或生产过程控制、变更制剂生产设备等。制剂生产工艺发生变更后,需进行相应的研究工作,评估变更对药品安全性、有效性和质量可控性的影响。研究工作宜根据以下方面综合进行:①变更对制剂的影响程度。②制剂生产工艺的复杂难易。③制剂剂型等。
化学合成原料药生产工艺变更主要指化学合成原料药生产工艺或半合成原料药的化学合成及之后生产工艺的变更,一般包括变更合成路线(如延长/缩短合成路线,变更起始原料等)、变更生产条件、变更物料控制/过程控制及其它可能的变更。 生产工艺变更可能只涉及上述某一种情况的变更,也可能涉及上述多种情况的变更。对于变更合成路线的,变更后合成路线中起始原料的选择应符合 ICH Q11 的相关要求。
( ICH Q11)
ICH Q11)
已上市中药的工艺变更包括:生产工艺路线、方法、参数等变更。 中药生产工艺变更可能涉及前处理、提取、分离纯化、浓缩、干燥、制剂成型等工艺的变更。生产工艺变更可能只涉及上述某一环节,也可能涉及多个环节,研究工作应按照技术要求较高的变更类别实施。
设备变更
设备:用于生产药品的自动化或非自动化、机械式或非机械式的设备,包括包装设备。
设备变更包括:
1)运送物料设备从非自动化或非机械化设备到自动化或机械化设备的变更
2)相同设计和工作原理、相同或不同容量的另一种设备的变更
3)不同设计和不同工作原理的设备的变更
原料药的设备变更:这部分针对的设备变更,是新设备的结构材料、设计或操作原理与当前主批记录中列出的设备不同。应上报现有生产设施的设备变更。使用合同生产商时,质量协议应确保将合同生产商处发生的设备变更应报告给主文件持有人或申请人。如果生产规模的重大变更导致最终合成步骤或其后步骤需要使用新设备或改变中控参数,则这个变更应视为多重变更。
如果将最终溶液步骤或其后工艺步骤使用的设备,更换成具有不同结构材料、设计或操作原理的新设备,则这样的变更最有可能对原料药的物理性质产生不良影响。例如以下工艺步骤所在设备:
场地变更/设施变更
对于原料药:设施变更包括中间体(包括最终中间体)、半成品原料药和成品原料药的生产地点(包括公司所有和合同加工工厂)的变更。当原料药生产商使用的生产设施与已获批申请所指定的不同时(如果此项变更还包括设施的取消,应在递交文件中通知监管机构取消哪个设施,以及哪个现有设施或新设施将代替拟定取消的设施的运作。),必须通知FDA。新的设施可能与旧的设施位于相同或不同的工业园区,但应具有类似的环境控制(例如,温度、湿度、交叉污染等)。 申请人或DMF持有人有责任确保所有新的生产设施按照CGMP规定运行。设施变更包括但不限于以下类型:
更换原料药生产商被视为原料药来源的变更而不是设施变更。 如果设施变更也涉及生产工艺、规模或设备的变化,则从报告数据和变更类别角度,这应视为多重变更。
由于中间体需要按照CGMP法规生产,当有多个用于生产中间体的设施时,建议对所有设施使用相同的质量标准和分析方法以确保同等质量。
相同的生产设施:城市中相邻街区内的完整场地或建筑群。
重大变更
重大变更(III类):指对生物制品安全性和有效性相关的质量属性可能有重大影响的变更。需要通过系列的研究证明变更对产品安全性、有效性和质量可控性没有产生影响。
重大变更是指有重大可能性对药品的鉴别、规格、质量、纯度或效价等涉及到药品安全性或有效性的相关因素产生不良影响的变更。这类补充申请被称为“需事先批准的补充申请(Prior Approval Supplement, PAS)
II类重大变更:即不是扩展并可能对药品相关的质量、安全性或有效性有重大影响的变更。
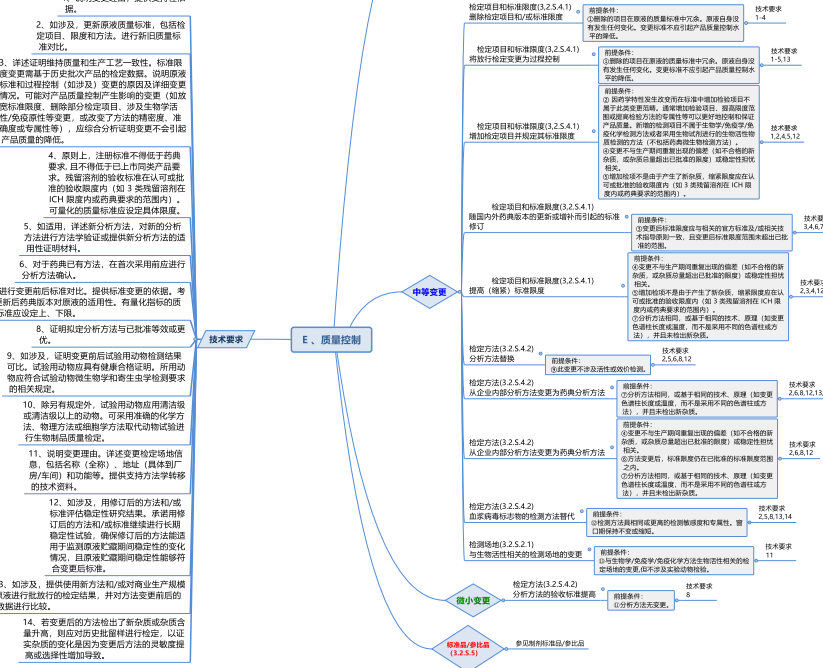
中度变更
中等变更(II类):指对生物制品安全性和有效性相关的质量属性可能有中等影响的变更。需要通过相应的研究证明变更对产品安全性、有效性和质量可控性不产生影响。如与重大变更相关的中等变更和微小变更,应在重大变更时说明,与中等变更相关的微小变更,应在中等变更中说明。
中度变更是指有中度可能性对药品的鉴别、规格、质量、纯度或效价等涉及到药品安全性或有效性的相关因素产生不良影响的变更。 有两种中度变更——“30天生效变更的补充申请(Supplement - Changes Being Effected in 30 Days)”和“立即生效变更的补充申请(Supplement - Changes Being Effected)”。见FDA指南 Changes to an Approved NDA or ANDA。
微小变更
微小变更(I类):指对生物制品安全性和有效性相关的质量属性基本不产生影响的变更。按照GMP管理的变更不属于此列。如与重大变更相关的中等变更和微小变更,应在重大变更时说明,与中等变更相关的微小变更,应在中等变更中说明。
微小变更是指有极小可能性对药品的鉴别、规格、质量、纯度或效价等涉及到药品安全性或有效性的相关因素有不良影响的变更。 申请人必须在下一年度报告中描述相关微小变更 。
这些微小变更对药品的质量、安全性或有效性只有最小的影响或根本没有影响,在实施前不需要事先批准(“做并告知”程序)。
变更管理
2、相关法规文件
2.1 FDA
1. 重大变更:有重大可能性对药品的特性、规格、质量、纯度或效价等涉及到药品安全性或有效性的相关因素产生不良影响的变更。 重大变更需要在使用变更生产的药品发运之前提交PAS并获得FDA批准。
2. 中等变更:有中等可能性对药品的特性、规格、质量、纯度或效价等涉及到药品安全性或有效性的相关因素产生不良影响的变更。根据变更的性质,中等表更必须向FDA提交以下两类补充申请中的一种:
A.补充申请 - 30天生效变更的补充申请(CBE-30补充申请)CBE-30补充申请涉及的中度变更需要在使用该变更生产的药品发运前至少30天向FDA提交补充申请。
B.补充申请 - 立即生效变更的补充申请(CBE-0补充申请)CBE-0补充申请涉及的中度变更允许使用该变更生产的药品在FDA收到该补充申请后即刻发运。
3. 微小变更:有极小可能性对药品的特性、规格、质量、纯度或效价等涉及到药品安全性或有效性的相关因素有不良影响的变更。 申请人必须在下一次年报中描述相关微小变更。
2.2 NMPA
药物临床试验期间,发生药物临床试验方案变更、非临床或者药学的变化或者有新发现的,申办者评估认为不影响受试者安全的,可以直接实施并在研发期间安全性更新报告中报告。可能增加受试者安全性风险的,应当提出补充申请。【详见药品注册管理办法 第二十九条】
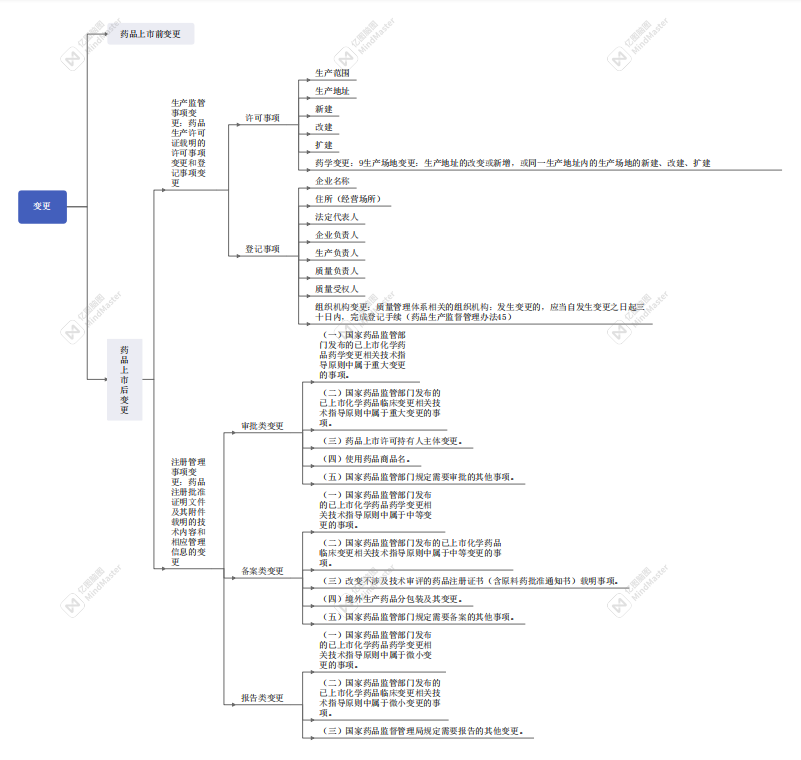
药品上市许可申请审评期间,发生可能影响药品安全性、有效性和质量可控性的重大变更的,申请人应当撤回原注册申请,补充研究后重新申报。申请人名称变更、注册地址名称变更等不涉及技术审评内容的,应当及时书面告知药品审评中心并提交相关证明性资料。【详见药品注册管理办法 第四十条】
药品上市后变更,按照其对药品安全性、有效性和质量可控性的风险和产生影响的程度,实行分类管理,分为审批类变更(第七十八条)、备案类变更(第七十九条)和报告类变更(第八十条)。对于药品生产过程中的重大变更,药品说明书中涉及有效性内容以及增加安全性风险的其他内容的变更,持有人转让药品上市许可等持有人应当以补充申请方式申报,经批准后实施;对药品生产过程中的中等变更以及药品包装标签内容的变更等,持有人应当在变更实施前,报所在地省、自治区、直辖市药品监督管理部门备案;对于药品生产过程中的微小变更等,持有人应当在年度报告中报告。【详见药品注册管理办法】
审批类变更的补充申请审评时限为六十日,补充申请合并申报事项的,审评时限为八十日,其中涉及临床试验研究数据审查、药品注册核查检验的审评时限为二百日【详见药品注册管理办法第九十六条】
疫苗上市许可持有人应当对疫苗进行质量跟踪分析,持续提升质量控制标准,改进生产工艺,提高生产工艺稳定性。
生产工艺、生产场地、关键设备等发生变更的,应当进行评估、验证,按照国务院药品监督管理部门有关变更管理的规定备案或者报告;变更可能影响疫苗安全性、有效性和质量可控性的,应当经国务院药品监督管理部门批准。【详见疫苗管理法第五十八条】
疫苗上市许可持有人应当根据疫苗上市后研究、预防接种异常反应等情况持续更新说明书、标签,并按照规定申请核准或者备案。
国务院药品监督管理部门应当在其网站上及时公布更新后的疫苗说明书、标签内容。【详见疫苗管理法第五十九条】
2.3 EU
对于不同程序获批的产品,申请人申报或咨询的对象不同:对集权程序(CP)获批产品,应向EMA递交申请;对仅在某成员国(NP)获批的产品,应向该成员国药监局递交申请;其他类别(DCP/MRP)获批的产品,则向参考成员国(Reference Member State,RMS)和相关成员国(Concerned Member State , CMS)递交申请。
Type IA 微小变更:对药品的质量、安全性和有效性影响很小或没有影响。此类变更应在变更实施后的12个月内,向所有有关监管部门提交通知(annual notification (AN));但对于持续监管的需要立即通知的药品,需要在变更实施后立即提交通知(immediate notification (IN))。
Type II 重大变更:不是Extensions,可能会对药品的质量安全性和有效性有重大影响。对于DCP/MRP获批产品,持有人同时向所有有关监管部门提交通知,RMS监管局应确认收到有效申请并知会持有人以及其他相关监管局:该程序从知会之日起开始;60天内,RMS监管局应准备好评估报告和对于该申请的决定,并传达给相关监管局;RMS可根据事件的紧急性缩短时限,延长适应症变更/新增适应症或组合变更的时限。对CP/NP获批产品,则分别为EMA和相应成员国药监局。(major (MAJ))
Type IB 微小变更:既不是Type IA型,也不是Type II型重大变更,也不是Extensions的。 对于DCP/MRP获批产品,应向有关监管局提交通知,RMS监管局与其他成员国协商后,确认收到了有效的通知,之后30天内,持有人未收到不利意见,则视为接受该变更通知;持有人收到不利意见的30天内,可提交修订通知,RMS在收到通知后30天内评估。 对CP/NP获批产品,则分别为EMA和相应成员国药监局。(minor (MIN))
Extensions:某些原料药的变更;规格、剂型和给药方式的变更;食用型动物用药的某些变更,或添加目标物种。该类上市许可应按照初始上市许可程序进行。
3、资源推荐
3.1 资源专题
#精选问答 · 变更
3.2 精选文章
变更必备知识与经验-文章专栏
3.3 推荐课程
变更|偏差|CAPA案例模版解析专题
化学药注册及变更解读课程
欧美等国际注册申报资料DMF准备的解读及分析

